原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1) 原子基态时外围电子轨道表示式为
原子基态时外围电子轨道表示式为______ ;
(2)由A、B、C形成的离子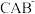 与
与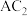 互为等电子体,则
互为等电子体,则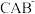 的结构式为
的结构式为______ ;
(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”
键” 或大
或大 键
键 。大
。大 键可用
键可用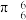 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大 键表示为
键表示为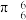
①下列微粒中存在“离域 键”的是
键”的是______ ;
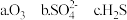
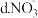
②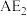 分子中大
分子中大 键可以表示为
键可以表示为______ ;
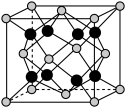
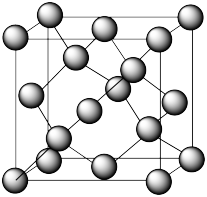
(4) 和D能够形成化合物X,其晶胞结构如图所示,晶胞参数
和D能够形成化合物X,其晶胞结构如图所示,晶胞参数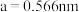 ,晶胞中C原子的配位数为
,晶胞中C原子的配位数为______ ;列式计算晶体X的密度______  。
。
(1)
 原子基态时外围电子轨道表示式为
原子基态时外围电子轨道表示式为(2)由A、B、C形成的离子
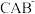 与
与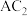 互为等电子体,则
互为等电子体,则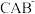 的结构式为
的结构式为(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”
键” 或大
或大 键
键 。大
。大 键可用
键可用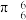 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大 键表示为
键表示为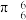
①下列微粒中存在“离域
 键”的是
键”的是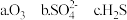
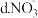
②
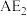 分子中大
分子中大 键可以表示为
键可以表示为(4)
 和D能够形成化合物X,其晶胞结构如图所示,晶胞参数
和D能够形成化合物X,其晶胞结构如图所示,晶胞参数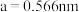 ,晶胞中C原子的配位数为
,晶胞中C原子的配位数为 。
。
更新时间:2020-01-13 16:22:25
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】氮元素在农药生产及工业、制造业等领域用途非常广泛。请根据提示回答下列问题∶
(1)N原子的最外层电子排布式为___ ,在第二周期元素中,第一电离能大于N的元素有___ 种。
(2)NH3是重要的配体,如[Cu(NH3)4]2+,NH3分子的VSEPR模型为____ ,其中H—N—H的键角为107.3°,则[Cu(NH3)4]2+中H—N—H的键角___ 107.3°(填“大于”“小于”“等于”)。
(3)甲基胺离子(CH3NH )的电子式为
)的电子式为_____ ,其中存在的共价键类型为____ (填极性键、非极性键、配位键)。已知(CH3)2NH比NH3接收质子的能力强,可能的原因是____ 。
(4)2-甲基吡啶(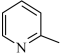 )是类似于苯的芳香化合物,分子中N原子的杂化类型为
)是类似于苯的芳香化合物,分子中N原子的杂化类型为___ 。1mol该物质中含有的σ键数目为____ 。
(5)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示

①晶胞的棱长为apm,则该晶体的密度为___ g/cm3(写出数学表达式,设NA为阿伏加德罗常数的值)。
②请画出该立方晶胞沿体对角线方向的投影图___ 。
(1)N原子的最外层电子排布式为
(2)NH3是重要的配体,如[Cu(NH3)4]2+,NH3分子的VSEPR模型为
(3)甲基胺离子(CH3NH
 )的电子式为
)的电子式为(4)2-甲基吡啶(
 )是类似于苯的芳香化合物,分子中N原子的杂化类型为
)是类似于苯的芳香化合物,分子中N原子的杂化类型为(5)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示

①晶胞的棱长为apm,则该晶体的密度为
②请画出该立方晶胞沿体对角线方向的投影图
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2•2CO•2H2O。回答下列问题:
(1)Cu在元素周期表中属于______ (选填“s”、“p”、“d”或“ds”)区元素。
(2)C、N、O三种原子中的第一电离能最大的是____________ 。NO3- 离子的空间构型是______ 。
(3)CO与N2互称等电子体。下表为CO和N2的有关信息。
根据表中数据,说明CO比N2活泼的原因是________________________ 。
(4)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
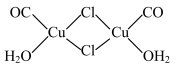
①该配合物中氯原子的杂化方式为_________________________ 。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______________________ 。
③1molCu2Cl2•2CO•2H2O含有的______________ 个σ键。
(1)Cu在元素周期表中属于
(2)C、N、O三种原子中的第一电离能最大的是
(3)CO与N2互称等电子体。下表为CO和N2的有关信息。
| 键的类型 | A-B(单键) | A=B(双键) | A≡B(叁键) | |
| 键能(kJ/mol) | CO | 351 | 803 | 1071 |
| N2 | 159 | 418 | 946 | |
根据表中数据,说明CO比N2活泼的原因是
(4)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:

①该配合物中氯原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
③1molCu2Cl2•2CO•2H2O含有的
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】某种水性钠离子电池电极材料属于配位化合物,使用过程中电极 嵌入或脱嵌,变化如下:格林绿
嵌入或脱嵌,变化如下:格林绿 普鲁士蓝
普鲁士蓝 普鲁士白,格林绿、普鲁士蓝、普鲁士白均为立方晶胞,省略
普鲁士白,格林绿、普鲁士蓝、普鲁士白均为立方晶胞,省略 的晶胞示意图如图1,嵌入和脱嵌过程中
的晶胞示意图如图1,嵌入和脱嵌过程中 均填充在小立方体的体心。X为上述三种晶体中的其中一种,如果不考虑
均填充在小立方体的体心。X为上述三种晶体中的其中一种,如果不考虑 ,所有微粒都只有一种化学环境,从X中切出的部分结构如图2所示。
,所有微粒都只有一种化学环境,从X中切出的部分结构如图2所示。

回答下列问题:
(1)从结构上分析基态 、
、 ,
,_______ 相对更稳定,原因是_______ 。
(2)配位化合物X中,N原子的杂化类型是_______ , 的配位数是
的配位数是_______ ,X中 键和
键和 键的数目之比为
键的数目之比为_______ 。
(3)格林绿、普鲁士蓝、普鲁士白的化学式可用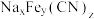 表示,后两者的化学式依次是
表示,后两者的化学式依次是_______ 、_______ 。
 嵌入或脱嵌,变化如下:格林绿
嵌入或脱嵌,变化如下:格林绿 普鲁士蓝
普鲁士蓝 普鲁士白,格林绿、普鲁士蓝、普鲁士白均为立方晶胞,省略
普鲁士白,格林绿、普鲁士蓝、普鲁士白均为立方晶胞,省略 的晶胞示意图如图1,嵌入和脱嵌过程中
的晶胞示意图如图1,嵌入和脱嵌过程中 均填充在小立方体的体心。X为上述三种晶体中的其中一种,如果不考虑
均填充在小立方体的体心。X为上述三种晶体中的其中一种,如果不考虑 ,所有微粒都只有一种化学环境,从X中切出的部分结构如图2所示。
,所有微粒都只有一种化学环境,从X中切出的部分结构如图2所示。
回答下列问题:
(1)从结构上分析基态
 、
、 ,
,(2)配位化合物X中,N原子的杂化类型是
 的配位数是
的配位数是 键和
键和 键的数目之比为
键的数目之比为(3)格林绿、普鲁士蓝、普鲁士白的化学式可用
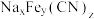 表示,后两者的化学式依次是
表示,后两者的化学式依次是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、B、C、D、E代表前四周期的五种元素,请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有两个电子,A元素原子的轨道表示式是______ 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为______ ,C的元素符号为______ 。
(3)D元素的正三价离子的 轨道为半充满,D的元素符号为
轨道为半充满,D的元素符号为______ ,其基态原子的价层电子排布式为______ 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为______ ,在元素周期表中的位置是______ 。
(1)A元素基态原子的最外层有3个未成对电子,次外层有两个电子,A元素原子的轨道表示式是
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为
(3)D元素的正三价离子的
 轨道为半充满,D的元素符号为
轨道为半充满,D的元素符号为(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】表为周期表的一部分,其中的字母代表对应的元素
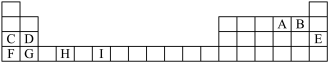
(1)元素Ⅰ的元素符号_______ ,I原子价电子排布图_______ ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的位置_______ 。
(2)表中元素第一电离能最小的是_______ (填元素符号,下同),电负性最大的是_______ ,化学性质最稳定的是_______ 。
(3)表中元素处于d区的是_______ (填元素符号)。
(4)某同学根据上述信息,推断D基态原子的核外电子排布图为(见图),该同学所画的电子排布图违背了_______ 。

(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。

(1)元素Ⅰ的元素符号
(2)表中元素第一电离能最小的是
(3)表中元素处于d区的是
(4)某同学根据上述信息,推断D基态原子的核外电子排布图为(见图),该同学所画的电子排布图违背了

(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为_______ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:2NaCl(l)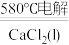 2Na(l)+Cl2(g)。加入CaCl2的目的是
2Na(l)+Cl2(g)。加入CaCl2的目的是_______ 。
(3)Na2O2的电子式为______ 。在25℃和101kPa时,Na与O2反应生成1molNa2O2放热510.9kJ,写出该反应的热化学方程式:_______ 。
(4)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过______ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
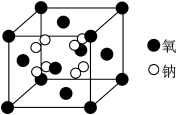
(5)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为_______ 。晶胞参数为apm,则该晶体的密度为______ g/cm3。(列计算式)
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:2NaCl(l)
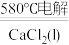 2Na(l)+Cl2(g)。加入CaCl2的目的是
2Na(l)+Cl2(g)。加入CaCl2的目的是(3)Na2O2的电子式为
(4)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(5)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮化硼( BN)是一种重要的功能陶瓷材料。以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和火箭高能燃料及有机合成催化剂BF3的过程如下:
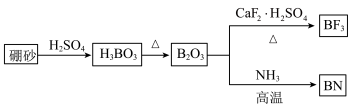
(1)写出由B203制备BF3的化学方程式 ,BF3中,B原子的杂化轨道类型为____________,BF3分子空间构型为____________。
(2)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)________________。
(3)已知:硼酸的电离方程式为H3B03 +H20 [B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____________,并推测1mol NH4BF4(氟硼酸铵)中含有____________个配位键。
[B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____________,并推测1mol NH4BF4(氟硼酸铵)中含有____________个配位键。
(4)由12个硼原子构成如图1的结构单元,硼晶体的熔点为1873℃,则硼晶体的1个结构单元中含有________________个B-B键。

(5)氮化硼(BN)晶体有多种相结构。六方相氮化硼(晶体结构如图2)是通常存在的稳定相可作高温润滑剂。立方相氮化硼(晶体结构如图3)是超硬材料,有优异的耐磨性。
①关于这两种晶体的说法,不正确的是____________(填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B-N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B-N键数与硼原子数之比为 __,其结构与石墨相似却不导电,原因是____________。
③立方相氮化硼晶体中,每个硼原子连接____________个六元环。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。

(1)写出由B203制备BF3的化学方程式 ,BF3中,B原子的杂化轨道类型为____________,BF3分子空间构型为____________。
(2)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)________________。
(3)已知:硼酸的电离方程式为H3B03 +H20
 [B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____________,并推测1mol NH4BF4(氟硼酸铵)中含有____________个配位键。
[B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____________,并推测1mol NH4BF4(氟硼酸铵)中含有____________个配位键。(4)由12个硼原子构成如图1的结构单元,硼晶体的熔点为1873℃,则硼晶体的1个结构单元中含有________________个B-B键。

(5)氮化硼(BN)晶体有多种相结构。六方相氮化硼(晶体结构如图2)是通常存在的稳定相可作高温润滑剂。立方相氮化硼(晶体结构如图3)是超硬材料,有优异的耐磨性。
①关于这两种晶体的说法,不正确的是____________(填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B-N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B-N键数与硼原子数之比为 __,其结构与石墨相似却不导电,原因是____________。
③立方相氮化硼晶体中,每个硼原子连接____________个六元环。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】非金属元素在化学中具有重要地位,请回答下列问题:
(1)下列氧原子轨道表达式中,能量最低的是区____ (填字母)。
A. B.
B.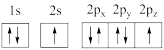
C.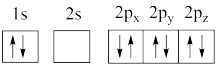 D.
D.
(2)与SO2分子互为等电子体的分子为____ 。
(3)lmol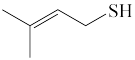 含有σ键数目为
含有σ键数目为____ 。
(4)(NH4)3PO4中P的___ 杂化轨道与O的2p轨道形成__ 键。
(5)元素X与硒(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X在元素周期表的位置_______ 。
(6)BF3与一定量的水形成晶体(H2O)2·BF3,结构式如下:
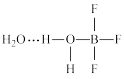
该晶体中各种微粒间的作用力不涉及_____ (填序号)。.
a.离子键b.共价键c.配位键d.金属键e.氢键f.范德华力
(7)金刚石的晶胞如下所示,已知该晶胞边长为356.7pm,其密度为___ g/cm3。(写出计算表达式即可)
(1)下列氧原子轨道表达式中,能量最低的是区
A.
 B.
B.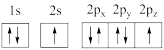
C.
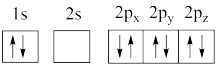 D.
D.
(2)与SO2分子互为等电子体的分子为
(3)lmol
 含有σ键数目为
含有σ键数目为(4)(NH4)3PO4中P的
(5)元素X与硒(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X在元素周期表的位置
(6)BF3与一定量的水形成晶体(H2O)2·BF3,结构式如下:

该晶体中各种微粒间的作用力不涉及
a.离子键b.共价键c.配位键d.金属键e.氢键f.范德华力
(7)金刚石的晶胞如下所示,已知该晶胞边长为356.7pm,其密度为

您最近一年使用:0次
【推荐1】过波金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)基态Cu原子核外K、L层电子的电子云有_____ 种不同的伸展方向。
(2)锌化铜是一种金属互化物,元素铜的第二电离能_____ (填“大于”、“小于”或“等于”)锌的第二电离能,理由是______ 。
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为(CH3)2SO。(CH3)2SO中C-S-O的键角______ (填“大于”、“小于”或“等于”)CH3COCH3中C-C-O的键角,理由是_____ ;元素S、Cl、O的电负性由大到小的顺序为______ 。
(4)利用CuSO4和NaOH制备的Cu(OH)2悬浊液检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为______ 。

②若Cu2O晶体密度为dg•cm-3,晶胞参数为apm,则阿伏加德罗常数值NA为______ (用含d和a的式子表示)。
(1)基态Cu原子核外K、L层电子的电子云有
(2)锌化铜是一种金属互化物,元素铜的第二电离能
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为(CH3)2SO。(CH3)2SO中C-S-O的键角
(4)利用CuSO4和NaOH制备的Cu(OH)2悬浊液检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为
②若Cu2O晶体密度为dg•cm-3,晶胞参数为apm,则阿伏加德罗常数值NA为
您最近一年使用:0次
【推荐2】利用“杯酚”从C60和C70的混合物中纯化C60的过程如下图所示_______ (填“共价键”“配位键”或“氢键”)形成“杯底”。
(2) (对叔丁基苯酚)与HCHO在一定条件下反应,生成“杯酚”和一种无机物。
(对叔丁基苯酚)与HCHO在一定条件下反应,生成“杯酚”和一种无机物。
①该无机物是_______ 。
②关于对叔丁基苯酚的叙述,不正确的是_______ (填序号)。
A.分子式为C10H14O B.分子中所有碳原子可能处于同一平面
C.易被空气中氧气氧化 D.1mol对叔丁基苯酚最多能与1molBr2反应。
(3)“杯酚”(图a)分离C60和C70的过程如图a,下列分析正确的是_______(填序号)。
(4)C60不溶于氯仿(化学式为CHCl3),“杯酚”溶于氯仿,可能的原因是_______ 。
(5)C60的晶胞结构如下所示:_______ 个C60分子。
②每个C60分子周围最多可以有_______ 个紧邻的C60分子。

(2)
 (对叔丁基苯酚)与HCHO在一定条件下反应,生成“杯酚”和一种无机物。
(对叔丁基苯酚)与HCHO在一定条件下反应,生成“杯酚”和一种无机物。①该无机物是
②关于对叔丁基苯酚的叙述,不正确的是
A.分子式为C10H14O B.分子中所有碳原子可能处于同一平面
C.易被空气中氧气氧化 D.1mol对叔丁基苯酚最多能与1molBr2反应。
(3)“杯酚”(图a)分离C60和C70的过程如图a,下列分析正确的是_______(填序号)。
| A.C60和和C70互为同素异形体 |
| B.C60熔点低于金刚石 |
| C.图a反映了超分子具有“分子识别”的特性 |
| D.图a利用了C60不溶于甲苯,C70易溶于CHCl3的性质 |
(5)C60的晶胞结构如下所示:

②每个C60分子周围最多可以有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】锌是一种重要的金属,锌及其化合物在生产生活中有着十分广泛的应用。
(1)基态锌原子的核外电子排布式为[Ar]___ 。
(2)在“Zn-e-→Zn+”过程中会__ (填“吸收”或“释放”)能量。
(3)代森锌是一种广谱杀菌剂,广泛用于防治各种麦的锈病、马铃薯晚疫病等蔬菜病害,遇水可分解为NH2—(CH2)2—NH2、CS2、H2S和ZnO。代森锌的结构简式如图所示。

①代森锌中Zn、N、S、H四种元素的电负性由大到小的次序为___ ,C原子的杂化轨道类型为___ 。
②NH2—(CH2)2—NH2、CS2、H2S三种化合物中沸点最高的是NH2—(CH2)2—NH2,其主要原因是___ 。
(4)[Zn(CN)4]2-形成的化合物可用作甲醛去除剂,[Zn(CN)4]2-中Zn2+与CN-之间的配位键中提供孤电子对的成键原子是___ (填元素符号),[Zn(CN)4]2-中σ键与π键的个数之比为___ 。
(5)化合物ZnS的晶胞结构如图,晶胞中部分离子的分数坐标如表所示,则ZnS晶胞结构中位置A的微粒为__ (填Zn2+或S2-),一个S2-周围等距离且最近的Zn2+构成的空间构型为___ ;已知ZnS晶体的密度为ρg·cm-3,则ZnS晶胞中的晶胞参数a=___ 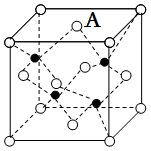
pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)基态锌原子的核外电子排布式为[Ar]
(2)在“Zn-e-→Zn+”过程中会
(3)代森锌是一种广谱杀菌剂,广泛用于防治各种麦的锈病、马铃薯晚疫病等蔬菜病害,遇水可分解为NH2—(CH2)2—NH2、CS2、H2S和ZnO。代森锌的结构简式如图所示。

①代森锌中Zn、N、S、H四种元素的电负性由大到小的次序为
②NH2—(CH2)2—NH2、CS2、H2S三种化合物中沸点最高的是NH2—(CH2)2—NH2,其主要原因是
(4)[Zn(CN)4]2-形成的化合物可用作甲醛去除剂,[Zn(CN)4]2-中Zn2+与CN-之间的配位键中提供孤电子对的成键原子是
(5)化合物ZnS的晶胞结构如图,晶胞中部分离子的分数坐标如表所示,则ZnS晶胞结构中位置A的微粒为

pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
| 坐标 | x | y | z |
| S2- | 0.25 | 0.25 | 0.25 |
| Zn2+ | 0 | 0 | 1 |
您最近一年使用:0次




