铬、钼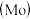 、钨
、钨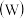 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
 铬元素的最高化合价为
铬元素的最高化合价为________ ;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________ 个未成对电子。
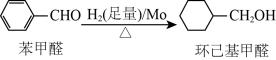
 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
 环己基甲醇分子中采取
环己基甲醇分子中采取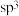 杂化的原子是
杂化的原子是________  写元素符号
写元素符号 。
。
 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是________ 。
 铬离子
铬离子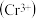 能形成多种配合物,例如
能形成多种配合物,例如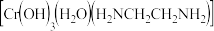 。
。
 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为________ 。
 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为________ 。
 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
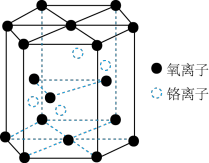
 该氧化物的化学式为
该氧化物的化学式为________ 。
 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为________  用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
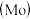 、钨
、钨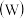 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。 铬元素的最高化合价为
铬元素的最高化合价为 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
 环己基甲醇分子中采取
环己基甲醇分子中采取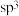 杂化的原子是
杂化的原子是 写元素符号
写元素符号 。
。 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是 铬离子
铬离子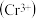 能形成多种配合物,例如
能形成多种配合物,例如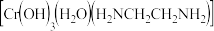 。
。 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
 该氧化物的化学式为
该氧化物的化学式为 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为 用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
更新时间:2020-02-03 16:57:19
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】Ⅰ.根据等电子体原理可知:
(1)仅由第二周期元素组成的共价分子中互为等电子体的有______ 组。
(2)在短周期元素组成的物质中,与NO 互为等电子体的分子有
互为等电子体的分子有______ 种。
(3)试预测N 的空间构型为
的空间构型为______ 。
Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应(见图)可以制得Ti3N4和纳米TiO2。
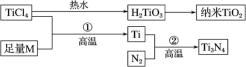
图中的M是短周期金属元素,M的部分电离能如下表:
(4)M是______ (填元素符号),该金属晶体的堆积模型为______ ,配位数为______ 。
(5)基态Ti3+中未成对电子数有______ 个;与Ti同族相邻的元素Zr的基态原子外围电子排布式为______ ;钛元素最高化合价为______ 。
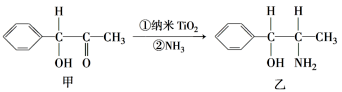
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子数为______ ,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为______ 。
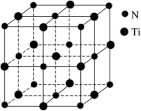
(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有______ 个。
科学家通过X射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为______ 。
(1)仅由第二周期元素组成的共价分子中互为等电子体的有
(2)在短周期元素组成的物质中,与NO
 互为等电子体的分子有
互为等电子体的分子有(3)试预测N
 的空间构型为
的空间构型为Ⅱ.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应(见图)可以制得Ti3N4和纳米TiO2。
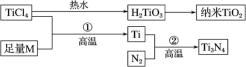
图中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ·mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
(4)M是
(5)基态Ti3+中未成对电子数有
(6)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子数为

(7)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为

科学家通过X射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】回答下列问题:
(1)已知乙醇在铜的催化下可以被氧化生成乙醛,而具有α-H的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合,生成β-羟基醛或β-羟基酮。以乙醛为例,其过程可表示如下:

请从元素电负性的角度解释第一步加成反应发生的原理:___________
(2)乙醛也能与甲胺(CH3NH2)中的-NH2发生类似反应。甲胺常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为___________ 。
(3)乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________ 。
(4)化工原料Z是X与HI反应的主产物,X→Z的反应机理如图:
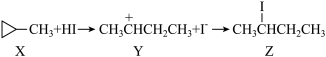
其中中间体Y中碳原子的轨道杂化方式为___________
(5)对羟基苯甲醛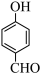 的沸点比邻羟基苯甲醛
的沸点比邻羟基苯甲醛 的沸点高,其原因是
的沸点高,其原因是___________ 。
(1)已知乙醇在铜的催化下可以被氧化生成乙醛,而具有α-H的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合,生成β-羟基醛或β-羟基酮。以乙醛为例,其过程可表示如下:

请从元素电负性的角度解释第一步加成反应发生的原理:
(2)乙醛也能与甲胺(CH3NH2)中的-NH2发生类似反应。甲胺常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为
(3)乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是
(4)化工原料Z是X与HI反应的主产物,X→Z的反应机理如图:
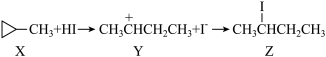
其中中间体Y中碳原子的轨道杂化方式为
(5)对羟基苯甲醛
 的沸点比邻羟基苯甲醛
的沸点比邻羟基苯甲醛 的沸点高,其原因是
的沸点高,其原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】三磷酸腺苷(ATP)和活性氧类(如H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是___________ ,基态N原子的电子排布图为___________ 。
(2)H2O2分子的氧原子的杂化轨道类型为:___________ ;H2O2和H2O能以任意比例互溶的原因是___________ 。(回答两点原因)
(3)O3分子的立体构型为___________ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是___________ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。___________ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为___________ 。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O2- | O3 |
| 键长/pm | 121 | 126 | 128 |
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
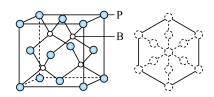
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。元素W比元素X序数小5。
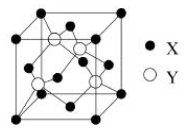
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为_____________ 。
②该化合物的化学式为_______________ 。
③写出元素W的价电子排布式______________ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________ 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_____________ 。
(4)Y与Z可形成YZ42-,YZ42-的空间构型为__________ (用文字描述)。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为_______ 。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为
②该化合物的化学式为
③写出元素W的价电子排布式
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(4)Y与Z可形成YZ42-,YZ42-的空间构型为
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
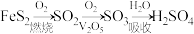
(1)基态Fe原子核外未成对电子数为___________ ,KSCN溶液是检验 的常用试剂,
的常用试剂, 中C原子的杂化类型为
中C原子的杂化类型为___________ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为___________ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大
表示,其中m代表参与形成大键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为___________ 。 分子中键角
分子中键角
___________  中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(3) 分子的空间构型为
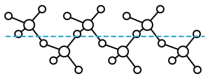
分子的空间构型为___________ 。固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是___________ (填“桥氧”或“端基氧”)。
(1)基态Fe原子核外未成对电子数为
 的常用试剂,
的常用试剂, 中C原子的杂化类型为
中C原子的杂化类型为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大
表示,其中m代表参与形成大键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)
 分子的空间构型为
分子的空间构型为 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________ 。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________ ,其原因是_____________________ 。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________ 。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____ 。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________ (填晶体类型)。
(4)金属铁晶体中原子采用_________ 堆积,铁晶体的空间利用率为______ (用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________ (填最简整数比);已知该晶体的密度为d g·cm-3,阿伏伽德罗常数的值为NA,则晶胞参数a为_______________ nm(用含d和NA的代数式表示)。

(1)基态铁原子的价电子排布式为
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于
(4)金属铁晶体中原子采用
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】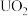 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: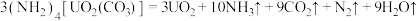 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为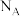 。
。
回答下列问题:
(1)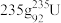 发生裂变反应:
发生裂变反应: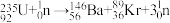 ,净产生的中子(
,净产生的中子(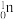 )数为
)数为________ 。基态 原子的外围电子排布式为
原子的外围电子排布式为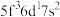 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________ (填序号)。
A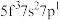 B
B 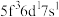 C
C  D
D 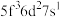
(2) 和
和 中,沸点较高的为
中,沸点较高的为________ ,与 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为________ 。
(3) 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为________ 。
(4)某种铀氮化物的晶体结构与 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
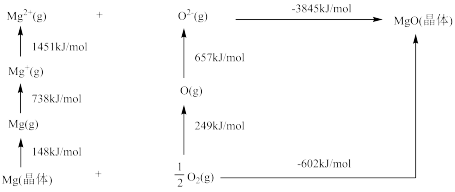
① 晶格能为
晶格能为________  。
。
② 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于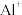 的半径较
的半径较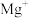 小、
小、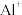 的核电荷更高以及
的核电荷更高以及_______ 。
(5)另一种铀氮化物的晶胞如下图所示, “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
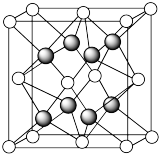
①铀元素的化合价为________ , “原子”的配位数为
“原子”的配位数为________ 。
②已知晶胞参数为 ,则晶体的密度为
,则晶体的密度为________  (列出计算式)。
(列出计算式)。
 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: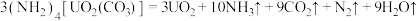 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为 。
。回答下列问题:
(1)
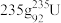 发生裂变反应:
发生裂变反应: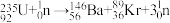 ,净产生的中子(
,净产生的中子(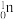 )数为
)数为 原子的外围电子排布式为
原子的外围电子排布式为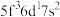 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为A
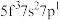 B
B 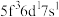 C
C  D
D 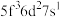
(2)
 和
和 中,沸点较高的为
中,沸点较高的为 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为(3)
 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为(4)某种铀氮化物的晶体结构与
 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
①
 晶格能为
晶格能为 。
。②
 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于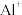 的半径较
的半径较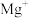 小、
小、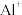 的核电荷更高以及
的核电荷更高以及(5)另一种铀氮化物的晶胞如下图所示,
 “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
①铀元素的化合价为
 “原子”的配位数为
“原子”的配位数为②已知晶胞参数为
 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】硫酸铜溶于过量的氨水中形成[Cu(NH3)4]SO4深蓝色的透明溶液。
(1)[Cu(NH3)4]SO4中的非金属元素H、N、O的电负性由大到小的顺序为__________________ (用元素符号回答)。
(2)[Cu(NH3)4] 2+中Cu2+与NH3之间形成的化学键为___________ ,提供孤电子对的成键原子是______________ 。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是__________ ,与该阴离子互为等电子体的五原子微粒有 _______________________ (填写一种即可)。
(1)[Cu(NH3)4]SO4中的非金属元素H、N、O的电负性由大到小的顺序为
(2)[Cu(NH3)4] 2+中Cu2+与NH3之间形成的化学键为
(3)[Cu(NH3)4]SO4中阴离子的空间构型是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】我国科学家发现催化剂 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。

(1)Fe元素在元素周期表中的位置是___________ 。
(2)污染物X在电极a上的反应式是___________ 。
(3)科研团队研究了X分别为 、
、 和
和 [也可以写作
[也可以写作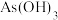 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
①基态As原子的价层电子排布式是___________ 。
② 中的键角
中的键角___________ (填“>”“<”或“=”) 中的键角。
中的键角。
③ 的结构是
的结构是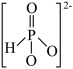 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是___________ 。
(4)比较反应能力:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(5) 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为___________ ( 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
(1)Fe元素在元素周期表中的位置是
(2)污染物X在电极a上的反应式是
(3)科研团队研究了X分别为
 、
、 和
和 [也可以写作
[也可以写作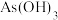 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。①基态As原子的价层电子排布式是
②
 中的键角
中的键角 中的键角。
中的键角。③
 的结构是
的结构是 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是(4)比较反应能力:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(5)
 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
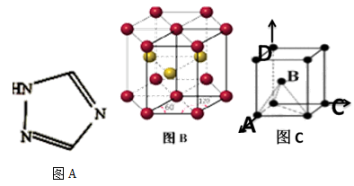
【推荐2】钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为___________ 。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为___________ 。

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___ (填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为____ 。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
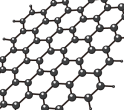
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___ ,石墨烯导电的原因是____ 。
(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
六溴苯的熔点比六氯苯高的原因是____ ,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___ 。
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__ g·cm-3。(NA是阿伏加 德罗常数的值,相关原子量:Nb—93)

(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是

(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
| 物质 | 六氯苯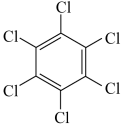 | 六溴苯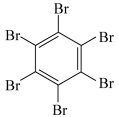 | 苯六酸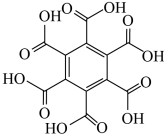 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
六溴苯的熔点比六氯苯高的原因是
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为

您最近一年使用:0次



