利用菱锰矿(主要成分是MnCO3,含少量A12O3、Fe2O3、FeO、CaO、MgO等)为原料制备MnO2的工艺流程如下:
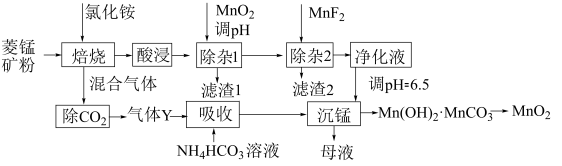
已知:①25℃时,
②相关金属离子 形成氢氧化物沉淀pH范围如下:
形成氢氧化物沉淀pH范围如下:
(1)“除杂1”中加入适量MnO2的作用是____ ,应调节溶液pH不小于____ 。
(2)“除杂2”的主要目的将Ca2+、Mg2+转化为相应的氟化物沉淀而除去,除去Ca2+的离子方程式为____ ,该反应的平衡常数为____ 。
(3)“沉锰”中生成Mn(OH)2'MnCO3沉淀的离子方程式为____ ,“母液”经加热等系列操作后可返回“____ ”工序循环使用。
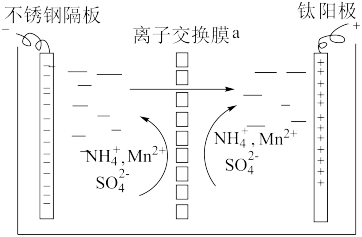
(4)以MnSO4-(NH4)2SO4为电解质溶液,利用下图装置可同时制备金属锰和MnO2。离子交换膜a为____ ,阳极电极反应式为____ 。

已知:①25℃时,

②相关金属离子
 形成氢氧化物沉淀pH范围如下:
形成氢氧化物沉淀pH范围如下:| 金属离子 | 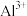 | 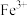 | 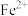 |  | 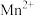 | 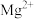 |
| 开始沉淀时的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全时的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(2)“除杂2”的主要目的将Ca2+、Mg2+转化为相应的氟化物沉淀而除去,除去Ca2+的离子方程式为
(3)“沉锰”中生成Mn(OH)2'MnCO3沉淀的离子方程式为
(4)以MnSO4-(NH4)2SO4为电解质溶液,利用下图装置可同时制备金属锰和MnO2。离子交换膜a为

更新时间:2020-03-15 10:42:20
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________ ;充入氮气,混合气体的密度__________________ (填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
①上述盐溶液中的阴离子,水解能力最弱的是__________________ 。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______ (填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______ (填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______ mol·L-1,此时溶液中c(CrO42-)等于_______ mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
(1)可逆反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
| T/K | 938 | 1100 |
| K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体和制备其它锰盐的原料,用于医药、电焊条辅助原料等。工业上利用木炭还原焙烧软锰矿煤粉制备碳酸锰的流程如图所示:
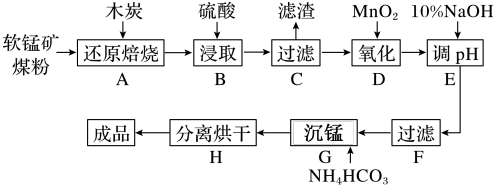
已知:①软锰矿煤粉的主要成分是MnO2,还含有少量CaCO3和Fe、Cu及其氧化物等。
②还原焙烧MnO2被还原成MnO。
③氧化能力S2O >MnO
>MnO >SO
>SO 。
。
可能用到的数据如表:
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器为酒精灯、三脚架、泥三角和______ ,其中MnO2发生的主要反应为______ (用方程式表示)。
(2)步骤C中滤渣的主要成分为木炭和______ (填化学式)。
(3)步骤E中调节pH值的范围是______ 。
(4)步骤G不能用Na2CO3溶液代替NH4HCO3溶液的原因是______ ,Mn2+恰好沉淀完全时,溶液中CO 的浓度为
的浓度为______ 。[Ksp(MnCO3)=2.2×10-11]
(5)S2O 中存在一个过氧键(-O-O-),则S2O
中存在一个过氧键(-O-O-),则S2O 中S的化合价为
中S的化合价为______ ,实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,设计实验确认Mn2+已经完全反应:______ 。

已知:①软锰矿煤粉的主要成分是MnO2,还含有少量CaCO3和Fe、Cu及其氧化物等。
②还原焙烧MnO2被还原成MnO。
③氧化能力S2O
 >MnO
>MnO >SO
>SO 。
。可能用到的数据如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)在实验室进行步骤A操作时,需要用到的主要仪器为酒精灯、三脚架、泥三角和
(2)步骤C中滤渣的主要成分为木炭和
(3)步骤E中调节pH值的范围是
(4)步骤G不能用Na2CO3溶液代替NH4HCO3溶液的原因是
 的浓度为
的浓度为(5)S2O
 中存在一个过氧键(-O-O-),则S2O
中存在一个过氧键(-O-O-),则S2O 中S的化合价为
中S的化合价为
您最近一年使用:0次
【推荐3】工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如图:
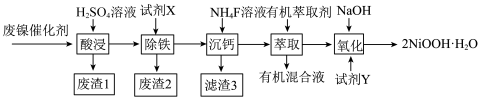
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)写出一种能提高“酸浸”速率的措施:___ ;滤渣1的成分是___ (填化学式)。
(2)试剂X用于调节溶液的pH,则调控pH的范围是___ 。
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=___ mol·L-1[已知实验条件下,Ksp(CaF2)=4×10-9,不考虑F-的水解]。
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:___ 。
(5)加入有机萃取剂的作用是___ 。
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为___ 。

相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Ca2+ | Zn2+ | Ni2+ | Fe3+ |
| 开始沉淀时的pH | 10.6 | 7.6 | 7.1 | 1.5 |
| 完全沉淀时的pH | 13.1 | 8.3 | 9.2 | 2.8 |
(1)写出一种能提高“酸浸”速率的措施:
(2)试剂X用于调节溶液的pH,则调控pH的范围是
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:
(5)加入有机萃取剂的作用是
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为
您最近一年使用:0次
【推荐1】四氯化钛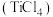 是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为
是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为 )为原料生产
)为原料生产 的化学反应原理为
的化学反应原理为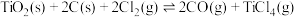

 。请回答下列问题:
。请回答下列问题:
(1)已知: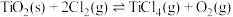
 、C(s)的燃烧热
、C(s)的燃烧热 为
为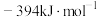 ,则CO的燃烧热
,则CO的燃烧热 为
为______  。
。
(2)T℃时,将足量的 、C加入某恒容密闭容器中,并通入一定量的
、C加入某恒容密闭容器中,并通入一定量的 和
和 (
( 不参与反应)只发生反应:
不参与反应)只发生反应: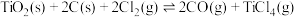 ,测得容器内总压强(
,测得容器内总压强( )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
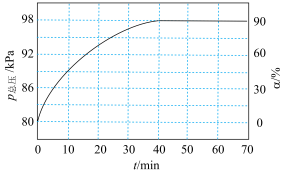
①T℃时,反应的平衡常数
______ kPa( 为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
②保持温度和起始总压相同,若向恒容密闭容器中通入的 中不含氮气,与含有氮气相比,
中不含氮气,与含有氮气相比, 的平衡转化率
的平衡转化率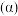
______ (填“增大”“减小”或“不变”),其原因为____________ 。
(3)利用 先制得
先制得 ,焙烧
,焙烧 可获得纳米
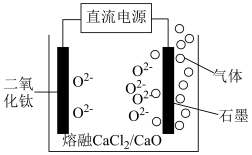
可获得纳米 。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原
。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原 得到钛,用化学用语表示制钛过程:
得到钛,用化学用语表示制钛过程:______ 、____________ ;石墨电极需要定期更换的原因为______ 。
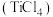 是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为
是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为 )为原料生产
)为原料生产 的化学反应原理为
的化学反应原理为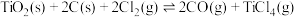

 。请回答下列问题:
。请回答下列问题:(1)已知:
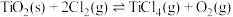
 、C(s)的燃烧热
、C(s)的燃烧热 为
为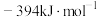 ,则CO的燃烧热
,则CO的燃烧热 为
为 。
。(2)T℃时,将足量的
 、C加入某恒容密闭容器中,并通入一定量的
、C加入某恒容密闭容器中,并通入一定量的 和
和 (
( 不参与反应)只发生反应:
不参与反应)只发生反应: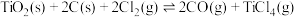 ,测得容器内总压强(
,测得容器内总压强(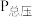 )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
①T℃时,反应的平衡常数

 为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。②保持温度和起始总压相同,若向恒容密闭容器中通入的
 中不含氮气,与含有氮气相比,
中不含氮气,与含有氮气相比, 的平衡转化率
的平衡转化率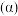
(3)利用
 先制得
先制得 ,焙烧
,焙烧 可获得纳米
可获得纳米 。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原
。用电解法生产钛的原理如图所示。电解过程中,被还原的Ca进一步还原 得到钛,用化学用语表示制钛过程:
得到钛,用化学用语表示制钛过程:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为 ,含
,含 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。

已知:①“碱浸”时, 中
中 以
以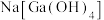 的形式进入溶液。
的形式进入溶液。
②离子完全沉淀时的 :
: 为8,
为8, 为5.6。
为5.6。
(1)As在周期表中的位置为___________ ,最高能级电子云轮廊图为___________ 形。第一电离能比较:
___________  (填“<”“>”或“=”,下同),原子半径比较:As
(填“<”“>”或“=”,下同),原子半径比较:As___________ Ga。
(2)下图为砷化镓晶胞,白球所代表原子的配位数是___________ 。已知:晶胞参数为apm,密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________ (用含a、d的式子表示)。

(3)“碱浸”时, 参加的离子方程式为
参加的离子方程式为___________ 。
(4)“调 ①”时,
①”时,
___________ 最合适;滤液②的溶质成分为___________ (写化学式)。
(5)写出用情性电极电解制备镓单质的电极反应方程式:___________ 。
 ,含
,含 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
已知:①“碱浸”时,
 中
中 以
以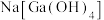 的形式进入溶液。
的形式进入溶液。②离子完全沉淀时的
 :
: 为8,
为8, 为5.6。
为5.6。(1)As在周期表中的位置为

 (填“<”“>”或“=”,下同),原子半径比较:As
(填“<”“>”或“=”,下同),原子半径比较:As(2)下图为砷化镓晶胞,白球所代表原子的配位数是
 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为
(3)“碱浸”时,
 参加的离子方程式为
参加的离子方程式为(4)“调
 ①”时,
①”时,
(5)写出用情性电极电解制备镓单质的电极反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】硫化氢(H2S)、二氧化硫(SO2)是有害气体,可用多种方法进行脱除。
(1)H2S和SO2的VSEPR模型分别为_______ 、_______ 。
(2)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应: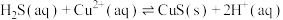 ,计算25℃时,该反应的平衡常数为
,计算25℃时,该反应的平衡常数为_______ 。(已知25℃时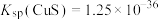 ,H2S的
,H2S的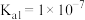 ,
,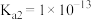 )
)
(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应: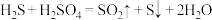 、
、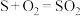 。
。
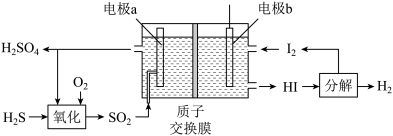
①电极a上发生反应的电极反应式为_______ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为_______ 。
(4)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是_______ (填化学式)
②将浓度均为0.1 mo/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是_______ 。
③根据表内数据,计算0.06 mol/L Na2SO3溶液的pH=_______ (忽略 的第二步水解)。
的第二步水解)。
④测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。
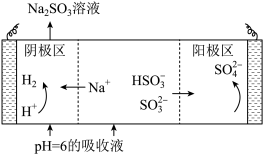
电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是_______ 。
(1)H2S和SO2的VSEPR模型分别为
(2)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的H2S气体,发生反应:
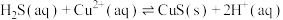 ,计算25℃时,该反应的平衡常数为
,计算25℃时,该反应的平衡常数为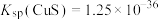 ,H2S的
,H2S的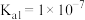 ,
,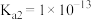 )
)(3)通过电化学循环法可将H2S转化为H2SO4和H2(如图所示)。其中氧化过程发生如下两步反应:
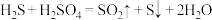 、
、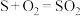 。
。
①电极a上发生反应的电极反应式为
②理论上1 mol H2S参加反应可产生H2的物质的量为
(4)硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+H2O+SO2=2NaHSO3。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | 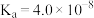 | 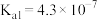 , ,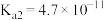 | 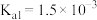 , ,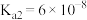 |
②将浓度均为0.1 mo/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是
③根据表内数据,计算0.06 mol/L Na2SO3溶液的pH=
 的第二步水解)。
的第二步水解)。④测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。

电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是
您最近一年使用:0次
【推荐1】利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O)。工业流程如图:
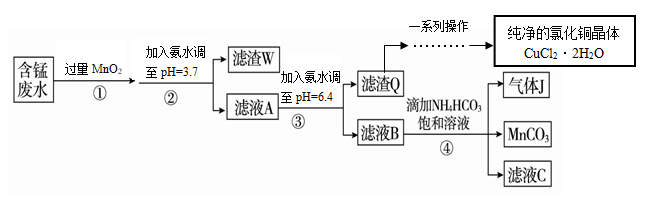
已知:几种金属离子沉淀的pH如表:
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为__ 。
(2)过程②中,所得滤渣W的成分是__ 。
(3)过程③中,调pH=6.4目的是__ 。
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是__ 。
(5)将滤渣Q溶解在过量的盐酸中,经过__ ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O)。
(6)从滤液C可得到的副产品是__ (填化学式)。

已知:几种金属离子沉淀的pH如表:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为
(2)过程②中,所得滤渣W的成分是
(3)过程③中,调pH=6.4目的是
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是
(5)将滤渣Q溶解在过量的盐酸中,经过
(6)从滤液C可得到的副产品是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室可用 和
和 为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
30℃时几种盐的溶解度/
制备纯碱的步骤如下:
①配制50 约25%的粗食盐水溶液(密度近似为1
约25%的粗食盐水溶液(密度近似为1 )。
)。
②精制食盐水(粗食盐中含有少量 、
、 、
、 等杂质),用盐酸将滤液的
等杂质),用盐酸将滤液的 值调至7。
值调至7。
③加热食盐水,将溶液温度控制在30~35℃。
④在不断搅拌下,分次将研细的 加入食盐水中,加完料后,继续保温、搅拌半小时。
加入食盐水中,加完料后,继续保温、搅拌半小时。
⑤静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是____________ 。
(2)步骤②中, 是否需要除去?
是否需要除去?__________ ,理由是________________ 。
(3)步骤④中所有操作的共同目的是__________________________ 。
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是___________________ 。
 和
和 为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:30℃时几种盐的溶解度/

 |  |  |  |  |  |  |  |  |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
①配制50
 约25%的粗食盐水溶液(密度近似为1
约25%的粗食盐水溶液(密度近似为1 )。
)。②精制食盐水(粗食盐中含有少量
 、
、 、
、 等杂质),用盐酸将滤液的
等杂质),用盐酸将滤液的 值调至7。
值调至7。③加热食盐水,将溶液温度控制在30~35℃。
④在不断搅拌下,分次将研细的
 加入食盐水中,加完料后,继续保温、搅拌半小时。
加入食盐水中,加完料后,继续保温、搅拌半小时。⑤静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是
(2)步骤②中,
 是否需要除去?
是否需要除去?(3)步骤④中所有操作的共同目的是
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7·2H2O),某实验小组模拟其流程如图所示:

(1)FeCr2O4中Cr的化合价为__________ ,步骤①焙烧时所用的仪器名称为______________ ;步骤①中生成Na2CrO4的化学方程式为____________________ 。
(2)步骤①焙烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为____________ 。
(3)步骤②过滤时所用到的玻璃仪器有_________________ 。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是______________ 、____________ 。
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为______________ 。
(6)如图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为______________________ 。


(1)FeCr2O4中Cr的化合价为
(2)步骤①焙烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为
(3)步骤②过滤时所用到的玻璃仪器有
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为
(6)如图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为

您最近一年使用:0次



