我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。
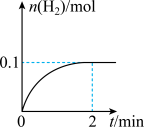
(1)0~2 min内的平均反应速率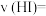
_____  平衡常数表达式为
平衡常数表达式为
_________________ 。
(2)相同温度下,若开始加入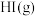 的物质的量是原来的2倍,则
的物质的量是原来的2倍,则____ 是原来的2倍。
A.平衡常数 B. 的平衡浓度
的平衡浓度
C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的_____ 。
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将 的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
① 浓度为 的氨水b L;②
的氨水b L;② 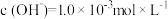 的氨水c L;③
的氨水c L;③ 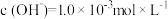 的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:
的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________ 。
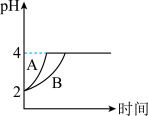
(5)常温下,取 的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是
的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___ (填“A”或“B”);设盐酸中加入的Zn质量为 ,醋酸溶液中加入的Zn质量为
,醋酸溶液中加入的Zn质量为 ,则
,则
___  。(选填“<”、“=”、“>”)
。(选填“<”、“=”、“>”)
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是____ 。
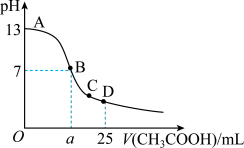
A.在A、B间任一点,溶液中一定都有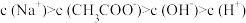
B.在B点, ,且有
,且有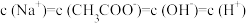
C.在C点: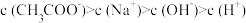
D.在D点:
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率
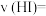
 平衡常数表达式为
平衡常数表达式为
(2)相同温度下,若开始加入
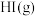 的物质的量是原来的2倍,则
的物质的量是原来的2倍,则A.平衡常数 B.
 的平衡浓度
的平衡浓度C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将
 的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。① 浓度为
 的氨水b L;②
的氨水b L;② 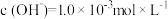 的氨水c L;③
的氨水c L;③ 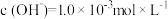 的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:
的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:(5)常温下,取
 的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是
的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ,醋酸溶液中加入的Zn质量为
,醋酸溶液中加入的Zn质量为 ,则
,则
 。(选填“<”、“=”、“>”)
。(选填“<”、“=”、“>”)
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是

A.在A、B间任一点,溶液中一定都有
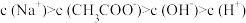
B.在B点,
 ,且有
,且有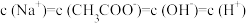
C.在C点:
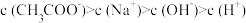
D.在D点:

14-15高三上·上海嘉定·期中 查看更多[2]
更新时间:2020-03-21 18:49:49
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】2022年中国航天在诸多领域实现重大突破。空间站一种处理 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:_______ 。
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g) CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =_____ kJ•mol-1。
②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是_______ 。
B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是_______ 。
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g) CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)= ______ mol•L-1•min-1;反应Ⅱ的平衡常数Kp=______ (Kp是用分压表示的平衡常数,用各组分的分压代替浓度)。
 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为: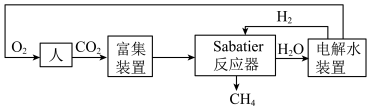
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是

B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g)
 CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________ 。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______ (填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________ 。
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______ 。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________ 。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g) CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________ (用百分数表示,小数点后保留1位)。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=| Fe2O3 | CO | Fe | CO2 | |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
①2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)②H2(g)+CO2(g)
 H2O(g)+CO(g)
H2O(g)+CO(g)③3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)
 CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】发展新能源、改善空气质量一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:
 ,该反应历程如图所示。合成甲醇过程中产生的有机副产物为
,该反应历程如图所示。合成甲醇过程中产生的有机副产物为
A. B.
B.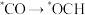
C. D.
D.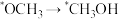
(2)焦炭与水蒸气在恒容密闭容器中反应可制合成气(CO和H2),主要反应Ⅰ、Ⅱ的
 (
( 为以分压表示的平衡常数)与T的关系如图所示。
为以分压表示的平衡常数)与T的关系如图所示。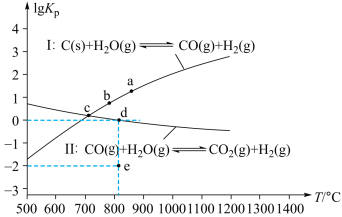
①反应Ⅰ的
②在容积为10 L的密闭容器中充入1 mol CO、1 mol H2O只发生反应Ⅱ,5 min时到达图2中的d点,则0~5 min内,用CO表示的反应速率为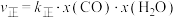 ,
,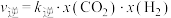 ,
, 、
、 分别为正、逆反应速率常数,x为物质的量分数,计算e点的
分别为正、逆反应速率常数,x为物质的量分数,计算e点的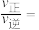
(3)c点时,若反应容器中CO的浓度为
 ,则CO2的浓度为
,则CO2的浓度为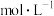 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】消除氮氧化物尾气和水中硝酸盐造成的氮污染已成为环境修复研究的热点。
(1)氧化吸收法
酸性条件下,NaClO 溶液可以氧化 N2O、NO 和 NO2等生成 Cl— 和 NO ,其他条件一定,N2O 转化为 NO
,其他条件一定,N2O 转化为 NO 的转化率随NaClO 溶液初始 pH 的变化如图所示:
的转化率随NaClO 溶液初始 pH 的变化如图所示:

①酸性 NaClO 溶液吸收N2O 的离子方程式为___________ 。
②NaClO 溶液的初始 pH 越小,N2O 转化率越高,其原因是___________ 。
③NaClO2/H2O2酸性复合吸收剂可有效脱除 NO。复合吸收剂组成一定时,温度对 NO 去除率的影响如图,温度高于 60℃后,NO 去除率下降的原因是___________ 。

(2)电化学法
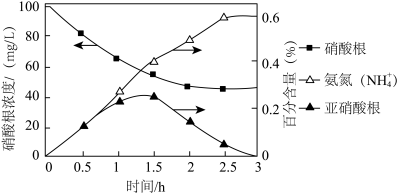
在通电的条件下,利用零价铁(Fe)去除弱酸性水体中 NO ,其原理如图所示:
,其原理如图所示:

①去除NO 的总反应离子方程式为
的总反应离子方程式为___________ 。
②溶液的初始 pH 值对铁的氧化产物和 NO 的去除率都有影响。取两份相同的含NO
的去除率都有影响。取两份相同的含NO 废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO
废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO 去除率低的原因是
去除率低的原因是___________ 。
(3)催化还原法
多相催化剂条件下,使用 H2作为还原剂,可将水中的 NO 转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO
转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO ) 浓度下降的原因是
) 浓度下降的原因是__________ 。
(1)氧化吸收法
酸性条件下,NaClO 溶液可以氧化 N2O、NO 和 NO2等生成 Cl— 和 NO
 ,其他条件一定,N2O 转化为 NO
,其他条件一定,N2O 转化为 NO 的转化率随NaClO 溶液初始 pH 的变化如图所示:
的转化率随NaClO 溶液初始 pH 的变化如图所示:
①酸性 NaClO 溶液吸收N2O 的离子方程式为
②NaClO 溶液的初始 pH 越小,N2O 转化率越高,其原因是
③NaClO2/H2O2酸性复合吸收剂可有效脱除 NO。复合吸收剂组成一定时,温度对 NO 去除率的影响如图,温度高于 60℃后,NO 去除率下降的原因是

(2)电化学法
在通电的条件下,利用零价铁(Fe)去除弱酸性水体中 NO
 ,其原理如图所示:
,其原理如图所示:
①去除NO
 的总反应离子方程式为
的总反应离子方程式为②溶液的初始 pH 值对铁的氧化产物和 NO
 的去除率都有影响。取两份相同的含NO
的去除率都有影响。取两份相同的含NO 废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO
废液, 调节起始 pH 分别为 2.5 和 4.5,一段时间后,测得实验结果如表所示,当初始pH=4.5, NO 去除率低的原因是
去除率低的原因是| 初始pH | pH=2.5 | pH=4.5 |
24小时后NO 的去除率 的去除率 | 接近100% | <50% |
| 铁的最终物质形态 |  | 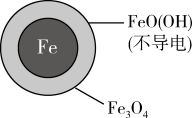 |
多相催化剂条件下,使用 H2作为还原剂,可将水中的 NO
 转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO
转化为 N2,因为不会带来二次污染的优点,受到了广泛关注。W-Cu/Al2O3催化剂还原硝酸盐过程中三种含氮微粒的变化如图所示,在 1.5~2.5h 过程中,亚硝酸盐氮(NO ) 浓度下降的原因是
) 浓度下降的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
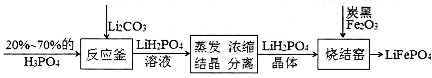
(1)反应釜中反应的化学方程式为_______ ,该反应体现出非金属性关系:P_____ C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数 随pH的变化如图2所示[
随pH的变化如图2所示[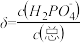 (含P元素的粒子)]。
(含P元素的粒子)]。
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________ 。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________ 。
(3)磷酸铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______ (填“阳极”或“阴极”);放电时,正极反应式为__________________ 。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________ 。
②铁的百分含量Fe(%)=_________________________ 。

(1)反应釜中反应的化学方程式为
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数
 随pH的变化如图2所示[
随pH的变化如图2所示[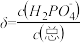 (含P元素的粒子)]。
(含P元素的粒子)]。
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=
(3)磷酸铁锂电池总反应为:LiFePO4+6C
 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是
②铁的百分含量Fe(%)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
则该反应的△H=______ kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
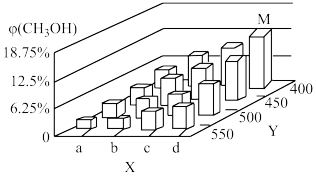
①图中a___ b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________ ;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________ (填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____ ;用H2表示I的反应速率为_____ mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c( )∶c(
)∶c( )=
)=___________ [已知H2CO3的电离平衡常数为:K1=4.4×10−7、K2=5×10−11],溶液中c(Na+)_______ c( )+2c(
)+2c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
| 共价键 | C―O | H―O | N―H | C―N |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:

①图中a
②若反应II的平衡常数K值变小,则下列说法中正确的是
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(
 )∶c(
)∶c( )=
)= )+2c(
)+2c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
您最近一年使用:0次



