钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________ 。
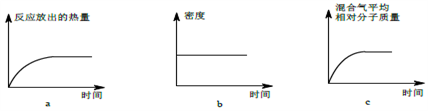
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______ (填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________ 。
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______ 。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________ 。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g) CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________ (用百分数表示,小数点后保留1位)。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=| Fe2O3 | CO | Fe | CO2 | |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
①2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)②H2(g)+CO2(g)
 H2O(g)+CO(g)
H2O(g)+CO(g)③3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)
 CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为
更新时间:2019/01/02 22:41:55
|
相似题推荐
【推荐1】减弱温室效应的方法之一是将CO2回收利用。回答下列问题:
(1)在催化剂存在下可将CO2应用于生产清洁燃料甲烷,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH1
副反应:CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
已知:H2和CH4的燃烧热分别为-285.5kJ·mol-1和-890.0kJ·mol-1
H2O(l)=H2O(g)ΔH=+44kJ·mol-1
①ΔH1=___ kJ·mol-1。
②有利于提高CH4平衡产率的反应条件是___ (至少写两条)。工业上提高甲烷反应选择性的关键因素是___ 。
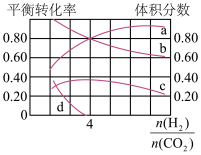
③T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的转化率,则表示H2转化率的是____ ,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知 =
=____ 时,甲烷产率最高。若该条件CO的产率趋于0,则T℃时主反应的平衡常数K=____ 。
(2)可利用NaOH溶液捕获CO2。若过程中所捕获的CO2刚好将NaOH完全转化为Na2CO3,则所得溶液中c(Na+)___ c(CO )+c(HCO
)+c(HCO )+c(H2CO3)(填“>”、“<”或“=”);若所得溶液中c(HCO
)+c(H2CO3)(填“>”、“<”或“=”);若所得溶液中c(HCO )∶c(CO
)∶c(CO )=2∶1,溶液pH=
)=2∶1,溶液pH=___ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
(1)在催化剂存在下可将CO2应用于生产清洁燃料甲烷,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH1
副反应:CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
已知:H2和CH4的燃烧热分别为-285.5kJ·mol-1和-890.0kJ·mol-1
H2O(l)=H2O(g)ΔH=+44kJ·mol-1
①ΔH1=
②有利于提高CH4平衡产率的反应条件是
③T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的转化率,则表示H2转化率的是
 =
=
(2)可利用NaOH溶液捕获CO2。若过程中所捕获的CO2刚好将NaOH完全转化为Na2CO3,则所得溶液中c(Na+)
 )+c(HCO
)+c(HCO )+c(H2CO3)(填“>”、“<”或“=”);若所得溶液中c(HCO
)+c(H2CO3)(填“>”、“<”或“=”);若所得溶液中c(HCO )∶c(CO
)∶c(CO )=2∶1,溶液pH=
)=2∶1,溶液pH=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】硫及其化合物在生产、生活中有着重要的应用价值。请按要求回答下列问题。
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ) 制氢的热化学方程式分别为_________ ;_________ ;制得等量H2所需能量较少的是系统_________ 。
(2)H2S 与CO2在高温下发生反应: H2S(g)+CO2(g) COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
①该反应平衡后H2O(g)的物质的量分数为0.3,H2S的平衡转化率α1=____ ,反应平衡常数K=____ 。
②在350℃重复试验,平衡后H2O(g)的物质的量分数为0.4,H2S的转化率α2_____ α1,(填“>”“<”或“=”)该反应的△H____ 0。
③测定钢铁中硫含量: 将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为____ ,滴定反应的离子方程式为__________ 。
已知25 ℃时,H2SO3的电离常数Ka1=1×10-2,Ka2=5×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____ 。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/c(HSO3-)将_______ (填“增大”、“减小”或“不变" ).
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ) 制氢的热化学方程式分别为
(2)H2S 与CO2在高温下发生反应: H2S(g)+CO2(g)
 COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。
COS(g)+H2O(g)。在340℃时,将0.10molCO2与0.10molH2S充入2.5 L的空钢瓶中。①该反应平衡后H2O(g)的物质的量分数为0.3,H2S的平衡转化率α1=
②在350℃重复试验,平衡后H2O(g)的物质的量分数为0.4,H2S的转化率α2
③测定钢铁中硫含量: 将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为
已知25 ℃时,H2SO3的电离常数Ka1=1×10-2,Ka2=5×10-8,则该温度下NaHSO3的水解平衡常数Kb=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:____________________ 。
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O  N2H62+ + OH- II
N2H62+ + OH- II
① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为__________ 。
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈_________ 性,溶液中N2H5+、Cl-、OH-、H+、N2H4浓度由大到小的顺序为___________________ 。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
温度较高时主要发生反应b:N2H4(g)+2O2(g) 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)
①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1___________________ K2。(填“>”、“<”或“=”)
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是___________________ 。
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中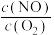 变大的是
变大的是___________________ 。
A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O
 N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O  N2H62+ + OH- II
N2H62+ + OH- II① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈

(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)温度较高时主要发生反应b:N2H4(g)+2O2(g)
 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中
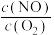 变大的是
变大的是A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g) C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1
②C3H8(g) C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol
③C2H4(g)+H2(g) C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g) CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol
(1)计算反应③的反应热△H3=______________ 。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图象判断△H2____ 0,工业生产中采用的温度600-650℃,原因是__________________ 。

(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________ (已知: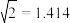 )
)
(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________ 。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________ ,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________ 。
①C3H8(g)
 C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1②C3H8(g)
 C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol③C2H4(g)+H2(g)
 C2H6(g) △H3
C2H6(g) △H3④C3H8(g) +H2(g)
 CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol(1)计算反应③的反应热△H3=
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图象判断△H2

(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)
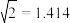 )
)(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为
您最近半年使用:0次
【推荐2】 是一种温室气体,研究
是一种温室气体,研究 的利用对促进低碳社会构建具有重要意义,我国科学家利用
的利用对促进低碳社会构建具有重要意义,我国科学家利用 作为催化剂,实现了
作为催化剂,实现了 加氢制
加氢制 .
.
主反应为:Ⅰ.

同时伴随发生副反应:Ⅱ.

(1)已知
 ,则
,则
______  .
.
(2)一定温度下,向某容器中充入2mol 和6mol
和6mol ,假设只发生上述反应Ⅰ,一段时间后达到平衡.
,假设只发生上述反应Ⅰ,一段时间后达到平衡.
①关于上述反应体系的分析,下列说法正确的是______ .
A.当 时,反应达到平衡状态
时,反应达到平衡状态
B.恒温恒压下,当混合气体的密度恒定时,反应达到平衡状态
C.保持容器的容积不变,向体系中充入氩气,平衡不移动
D.改加高效催化剂,可以提高 的平衡转化率
的平衡转化率
②恒容条件下,测得反应过程中 和
和 的物质的量浓度随时间的变化如图所示,该温度下的平衡常数
的物质的量浓度随时间的变化如图所示,该温度下的平衡常数
______ (保留小数点后两位).

(3)在恒温恒容的密闭容器中,加入一定量的 和足量的
和足量的 ,同时发生主、副反应.体系中
,同时发生主、副反应.体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:
①
______ 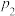 (填“>”或“=”或“<”).
(填“>”或“=”或“<”).
② 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是______ .
③科学家研究了用电解法把 转化为
转化为 ,从而消除
,从而消除 对环境的影响,其原理如图所示:
对环境的影响,其原理如图所示:

则图中A电极接电源______ 极.已知B电极为惰性电极,则在水溶液中,该极的电极反应式为______ .
 是一种温室气体,研究
是一种温室气体,研究 的利用对促进低碳社会构建具有重要意义,我国科学家利用
的利用对促进低碳社会构建具有重要意义,我国科学家利用 作为催化剂,实现了
作为催化剂,实现了 加氢制
加氢制 .
.主反应为:Ⅰ.


同时伴随发生副反应:Ⅱ.


(1)已知

 ,则
,则
 .
.(2)一定温度下,向某容器中充入2mol
 和6mol
和6mol ,假设只发生上述反应Ⅰ,一段时间后达到平衡.
,假设只发生上述反应Ⅰ,一段时间后达到平衡.①关于上述反应体系的分析,下列说法正确的是
A.当
 时,反应达到平衡状态
时,反应达到平衡状态B.恒温恒压下,当混合气体的密度恒定时,反应达到平衡状态
C.保持容器的容积不变,向体系中充入氩气,平衡不移动
D.改加高效催化剂,可以提高
 的平衡转化率
的平衡转化率②恒容条件下,测得反应过程中
 和
和 的物质的量浓度随时间的变化如图所示,该温度下的平衡常数
的物质的量浓度随时间的变化如图所示,该温度下的平衡常数

(3)在恒温恒容的密闭容器中,加入一定量的
 和足量的
和足量的 ,同时发生主、副反应.体系中
,同时发生主、副反应.体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:
①

 (填“>”或“=”或“<”).
(填“>”或“=”或“<”).②
 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是③科学家研究了用电解法把
 转化为
转化为 ,从而消除
,从而消除 对环境的影响,其原理如图所示:
对环境的影响,其原理如图所示:
则图中A电极接电源
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ·mol-1、283.0kJ·mol-1、285.8kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=_______ 。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g) ΔH<0,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
①用H2表示前2h平均反应速率v(H2)=_______ 。
②该温度下CO2的平衡转化率为_______ 。
③达到平衡后,改变下列条件,能够提高CO2转化率的是_______ 。
A.加入催化剂 B.压缩体积 C.升高温度 D.分离出水蒸气
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=_______ MPa-2 (计算结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ·mol-1、283.0kJ·mol-1、285.8kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g) ΔH<0,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②该温度下CO2的平衡转化率为
③达到平衡后,改变下列条件,能够提高CO2转化率的是
A.加入催化剂 B.压缩体积 C.升高温度 D.分离出水蒸气
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:(1)反应N2(g)+3H2(g) 2NH3(g) △H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图象能正确表示该过程中相关量的变化的是
2NH3(g) △H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图象能正确表示该过程中相关量的变化的是__________ 。(选填字母)。
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的7/10,则N2的转化率a1=________ ;
若向该容器中再加入1molN2和3molH2,达到平衡状态时,N2的转化率为a2,则a2________ a1(填“>”、“<”或“=”)。
(3)2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。

①比较P1、P2的大小关系:P1____ P2(填“>”、“<”或“=”)。
②随温度升高,该反应平衡常数变化的趋势是__________ 。
(4)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________________________________ 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是___________________________________________ 。
 2NH3(g) △H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图象能正确表示该过程中相关量的变化的是
2NH3(g) △H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图象能正确表示该过程中相关量的变化的是
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的7/10,则N2的转化率a1=
若向该容器中再加入1molN2和3molH2,达到平衡状态时,N2的转化率为a2,则a2
(3)2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较P1、P2的大小关系:P1
②随温度升高,该反应平衡常数变化的趋势是
(4)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】利用甲醇催化脱氢法制备甲酸甲酯涉及到如下化学反应:
反应Ⅰ:
 ,
,
反应Ⅱ:
 ,
,
反应Ⅲ: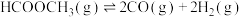
 ,
,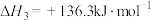
回答下列问题:
(1)
______  。
。
______ (用 、
、 表示)。
表示)。
(2)250℃,向密闭容器中通入 ,恒压条件下只发生反应Ⅰ。
,恒压条件下只发生反应Ⅰ。
①下列有关说法正确的是______ (填字母)。
A.高温有利于反应Ⅰ自发
B.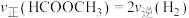 说明该反应体系达到平衡状态
说明该反应体系达到平衡状态
C.升高温度有利于提高 的平衡转化率
的平衡转化率
D.通过增大 分压可以提高
分压可以提高 的平衡产率
的平衡产率
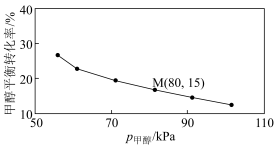
②250℃,测得反应Ⅰ的平衡转化率和进料时甲醇的分压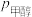 关系如图(分压
关系如图(分压 总压
总压 物质的量分数)。若起始时通入2mol甲醇,M点
物质的量分数)。若起始时通入2mol甲醇,M点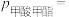
______  (结果精确至0.01);该反应的平衡常数
(结果精确至0.01);该反应的平衡常数
______  (
( 为以分压表示的平衡常数,列出计算式即可,无需化简)。
为以分压表示的平衡常数,列出计算式即可,无需化简)。
(3)一种在 上高度分散的铜颗粒催化剂
上高度分散的铜颗粒催化剂 制备方法如下:CuO
制备方法如下:CuO 酸性硅溶胶
酸性硅溶胶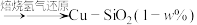 。为测试催化剂性能,将甲醇蒸汽以
。为测试催化剂性能,将甲醇蒸汽以 的流速通过负载
的流速通过负载 的催化反应器,甲醇转化率和甲酸甲酯选择性随
的催化反应器,甲醇转化率和甲酸甲酯选择性随 、反应温度的变化如下。
、反应温度的变化如下。
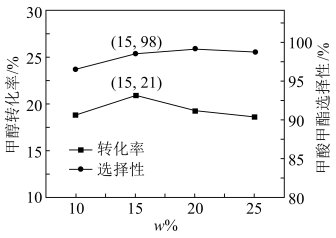

①如图,当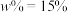 时,生成甲酸甲酯的反应速率为
时,生成甲酸甲酯的反应速率为______ 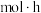 (列出计算式)。
(列出计算式)。
②最适合的反应温度为______ (填字母)。
A.553K B.563K C.573K D.583K
③如图,当温度高于563K时,甲酸甲酯选择性下降的可能原因为______ 。
反应Ⅰ:

 ,
,
反应Ⅱ:

 ,
,
反应Ⅲ:
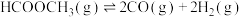
 ,
,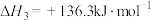
回答下列问题:
(1)

 。
。
 、
、 表示)。
表示)。(2)250℃,向密闭容器中通入
 ,恒压条件下只发生反应Ⅰ。
,恒压条件下只发生反应Ⅰ。①下列有关说法正确的是
A.高温有利于反应Ⅰ自发
B.
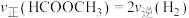 说明该反应体系达到平衡状态
说明该反应体系达到平衡状态C.升高温度有利于提高
 的平衡转化率
的平衡转化率D.通过增大
 分压可以提高
分压可以提高 的平衡产率
的平衡产率②250℃,测得反应Ⅰ的平衡转化率和进料时甲醇的分压
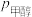 关系如图(分压
关系如图(分压 总压
总压 物质的量分数)。若起始时通入2mol甲醇,M点
物质的量分数)。若起始时通入2mol甲醇,M点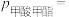
 (结果精确至0.01);该反应的平衡常数
(结果精确至0.01);该反应的平衡常数
 (
( 为以分压表示的平衡常数,列出计算式即可,无需化简)。
为以分压表示的平衡常数,列出计算式即可,无需化简)。
(3)一种在
 上高度分散的铜颗粒催化剂
上高度分散的铜颗粒催化剂 制备方法如下:CuO
制备方法如下:CuO 酸性硅溶胶
酸性硅溶胶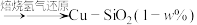 。为测试催化剂性能,将甲醇蒸汽以
。为测试催化剂性能,将甲醇蒸汽以 的流速通过负载
的流速通过负载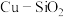 的催化反应器,甲醇转化率和甲酸甲酯选择性随
的催化反应器,甲醇转化率和甲酸甲酯选择性随 、反应温度的变化如下。
、反应温度的变化如下。

①如图,当
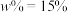 时,生成甲酸甲酯的反应速率为
时,生成甲酸甲酯的反应速率为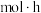 (列出计算式)。
(列出计算式)。②最适合的反应温度为
A.553K B.563K C.573K D.583K
③如图,当温度高于563K时,甲酸甲酯选择性下降的可能原因为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】碳、氮能形成多种氧化物、氢化物
(1)已知:①2NO(g) N2(g)+O2(g)△H1=-180.5 kJ·mol-1
N2(g)+O2(g)△H1=-180.5 kJ·mol-1
②CO(g)+ O2(g)
O2(g) CO2(g)△H2=-283 kJ·mol-1
CO2(g)△H2=-283 kJ·mol-1
则NO与CO反应生成两种无毒气体的热化学方程式为_______ 。
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图所示。

①如果不考虑催化剂价格,则使用催化剂_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成CO2的速率大小关系是_______ 。
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g) N2(g)+2CO2(g)在该温度下的平衡常数K=
N2(g)+2CO2(g)在该温度下的平衡常数K=_______ L·mol-1。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB→cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g) NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ._______ =NO3+_______ ;Ⅱ.略,这两个反应中活化能较小的是_______ 。
②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:则该温度下的反应速率常数k=_______ L·mol-1·s-1.
(1)已知:①2NO(g)
 N2(g)+O2(g)△H1=-180.5 kJ·mol-1
N2(g)+O2(g)△H1=-180.5 kJ·mol-1②CO(g)+
 O2(g)
O2(g) CO2(g)△H2=-283 kJ·mol-1
CO2(g)△H2=-283 kJ·mol-1则NO与CO反应生成两种无毒气体的热化学方程式为
(2)使用高效催化剂可大大减少汽车尾气排放出的NOx含量,某研究所的科研人员探究了T1℃时等质量的三种催化剂对CO还原NO的催化效果(其他条件相同),所得结果如图所示。

①如果不考虑催化剂价格,则使用催化剂
②若容器容积为2 L,开始时加入0.5 mol NO、0.5 mol CO,在催化剂Ⅰ的作用下达到如图1所示平衡,则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)在该温度下的平衡常数K=
N2(g)+2CO2(g)在该温度下的平衡常数K=(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB→cC+dD,其速率方程式为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应NO2(g)+CO(g)
 NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.
NO(g)+CO2(g)△H<0,在温度低于250℃时是由两个基元反应构成的复杂反应,该反应的速率方程式为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ.②某科研小组测得380℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:则该温度下的反应速率常数k=
| c(CO)/(mol·L-1) | 0.025 | 0.05 | 0.025 |
| c(NO2)/(mol·L-1) | 0.04 | 0.04 | 0.12 |
| v(CO2)/(mol·L-1·s-1) | 2.2×10-4 | 4.4×10-4 | 6.6×10-4 |
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
(1) 氧化反应:
氧化反应: 分两步进行,
分两步进行,
反应Ⅰ.
反应Ⅱ.
其反应过程能量变化示意图如图a所示。其中决定 氧化反应速率的步骤是反应
氧化反应速率的步骤是反应___________ (填“Ⅰ”或“Ⅱ”)。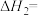
___________  (用a、b表示)。
(用a、b表示)。

(2)一定条件下将 和
和 按物质的量之比2:1充入某密闭反应容器,发生反应:
按物质的量之比2:1充入某密闭反应容器,发生反应: 。其他条件相同时,分别测得
。其他条件相同时,分别测得 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图b所示。
)下随温度变化的曲线如图b所示。
①
___________ (填“>”“<”或“=”) 。
。
②400℃、 条件下,
条件下, 的体积分数为
的体积分数为___________ %(保留小数点后一位小数)。
③700℃、 条件下,该反应的平衡常数
条件下,该反应的平衡常数
___________ (以分压表示,分压=总压×物质的量分数)。
(3)恒容条件下,为提高 转化为
转化为 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为___________ (任写一种)。
(4)还可用间接电解法除 。其原理如图所示:
。其原理如图所示:

①从A口中出来的气体是___________ 。
②写出电解池阴极的电极反应式___________ 。
③用离子方程式表示吸收柱中除去 的原理
的原理___________ 。
(1)
 氧化反应:
氧化反应: 分两步进行,
分两步进行,反应Ⅰ.

反应Ⅱ.

其反应过程能量变化示意图如图a所示。其中决定
 氧化反应速率的步骤是反应
氧化反应速率的步骤是反应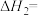
 (用a、b表示)。
(用a、b表示)。
(2)一定条件下将
 和
和 按物质的量之比2:1充入某密闭反应容器,发生反应:
按物质的量之比2:1充入某密闭反应容器,发生反应: 。其他条件相同时,分别测得
。其他条件相同时,分别测得 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图b所示。
)下随温度变化的曲线如图b所示。①

 。
。②400℃、
 条件下,
条件下, 的体积分数为
的体积分数为③700℃、
 条件下,该反应的平衡常数
条件下,该反应的平衡常数
(3)恒容条件下,为提高
 转化为
转化为 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(4)还可用间接电解法除
 。其原理如图所示:
。其原理如图所示:
①从A口中出来的气体是
②写出电解池阴极的电极反应式
③用离子方程式表示吸收柱中除去
 的原理
的原理
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。我国某地的矿山富含铜多金属矿(主要含Cu2S、Sc2S3、FeS、CaS和SiO2),科研人员从矿石中综合回收金属钪的工艺流程设计如下:

已知:①"萃取"时发生反应有:Sc3++3H2A2(有机液) Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+
②常温下,“萃取”前溶液中c(Sc3+)=0.60mol·L-1,Ksp[Sc(OH)3]=6.0×10-31;请回答下列问题:
(1)“加热酸溶”产生的气体直接排放到空气中,容易形成___________ ;滤渣I的主要成分为___________ 。
(2)溶解FeS发生反应的化学方程式为___________ 。
(3)“还原”工序的目的为___________ 。
(4)“萃取"过程中有机试剂的Se3+萃取率与“萃取”前溶液pH的关系如图。当pH大于a时随着pH增大Sc3+萃取率减小,a=___________ 。

(5)“沉钪"过程中发生反应的离子方程式为___________ 。过量焦炭、Sc2O3、Cl2混合物在高温下反应的化学方程式为___________ 。
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,钪在___________ 电极上得到(选填:石墨或液态锌)。

已知:①"萃取"时发生反应有:Sc3++3H2A2(有机液)
 Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+②常温下,“萃取”前溶液中c(Sc3+)=0.60mol·L-1,Ksp[Sc(OH)3]=6.0×10-31;请回答下列问题:
(1)“加热酸溶”产生的气体直接排放到空气中,容易形成
(2)溶解FeS发生反应的化学方程式为
(3)“还原”工序的目的为
(4)“萃取"过程中有机试剂的Se3+萃取率与“萃取”前溶液pH的关系如图。当pH大于a时随着pH增大Sc3+萃取率减小,a=

(5)“沉钪"过程中发生反应的离子方程式为
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,钪在
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】在我国大力推进生态文明建设,全力实现“碳达峰”、“碳中和”的时代背景下,对 的认识及其再利用的研究尤为重要。
的认识及其再利用的研究尤为重要。
(1)海水中溶解一定量 ,主要含有的离子是
,主要含有的离子是 、
、 、
、 、
、 、
、 、
、 。
。
①海水的弱碱性(pH约为8.1)有利于维持海洋生态环境,请用离子方程式解释海水呈弱碱性的原因___________ 、___________ 。
②炎炎夏日,海水的pH会___________ (填“升高”、“降低”或“不变”),其原因是___________ 。
③随着人类活动的影响,过量的 的排放使得海水酸性增强,海洋生态系统面临巨大威胁,有研究者提出,用如图所示方法可从海水中提取
的排放使得海水酸性增强,海洋生态系统面临巨大威胁,有研究者提出,用如图所示方法可从海水中提取 。
。

a室电极反应方程式为___________ ,在b室实现 提取,发生的反应离子方程式为
提取,发生的反应离子方程式为___________ 。
(2)“碳捕捉技术”可实现 的分离、储存和利用,其流程如下所示。
的分离、储存和利用,其流程如下所示。

已知:25℃时, 电离常数分别为
电离常数分别为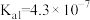 、
、 。
。
溶液中含碳物种的浓度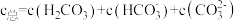 。
。
④若忽略溶液体积的变化,以0.1 NaOH溶液捕捉
NaOH溶液捕捉 ,当NaOH溶液吸收
,当NaOH溶液吸收 至溶液中含碳物种的浓度
至溶液中含碳物种的浓度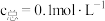 溶液时,
溶液时,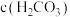
___________ 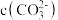 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
⑤整个流程中,可循环利用的物质有___________ 、___________ (填写物质的化学式)。
 的认识及其再利用的研究尤为重要。
的认识及其再利用的研究尤为重要。(1)海水中溶解一定量
 ,主要含有的离子是
,主要含有的离子是 、
、 、
、 、
、 、
、 、
、 。
。①海水的弱碱性(pH约为8.1)有利于维持海洋生态环境,请用离子方程式解释海水呈弱碱性的原因
②炎炎夏日,海水的pH会
③随着人类活动的影响,过量的
 的排放使得海水酸性增强,海洋生态系统面临巨大威胁,有研究者提出,用如图所示方法可从海水中提取
的排放使得海水酸性增强,海洋生态系统面临巨大威胁,有研究者提出,用如图所示方法可从海水中提取 。
。
a室电极反应方程式为
 提取,发生的反应离子方程式为
提取,发生的反应离子方程式为(2)“碳捕捉技术”可实现
 的分离、储存和利用,其流程如下所示。
的分离、储存和利用,其流程如下所示。
已知:25℃时,
 电离常数分别为
电离常数分别为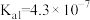 、
、 。
。溶液中含碳物种的浓度
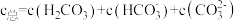 。
。④若忽略溶液体积的变化,以0.1
 NaOH溶液捕捉
NaOH溶液捕捉 ,当NaOH溶液吸收
,当NaOH溶液吸收 至溶液中含碳物种的浓度
至溶液中含碳物种的浓度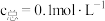 溶液时,
溶液时,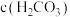
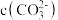 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。⑤整个流程中,可循环利用的物质有
您最近半年使用:0次



