肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:____________________ 。
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O  N2H62+ + OH- II
N2H62+ + OH- II
① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为__________ 。
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈_________ 性,溶液中N2H5+、Cl-、OH-、H+、N2H4浓度由大到小的顺序为___________________ 。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
温度较高时主要发生反应b:N2H4(g)+2O2(g) 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)
①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1___________________ K2。(填“>”、“<”或“=”)
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是___________________ 。
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中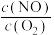 变大的是
变大的是___________________ 。
A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O
 N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O  N2H62+ + OH- II
N2H62+ + OH- II① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈

(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)温度较高时主要发生反应b:N2H4(g)+2O2(g)
 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中
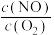 变大的是
变大的是A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
更新时间:2017-04-02 22:36:03
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】废 催化剂(含
催化剂(含 、
、 、
、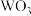 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。 、
、 和
和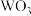 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的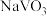 、
、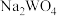 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③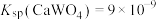 。
。
回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:___________ 。
(2)碱浸步骤可以提高浸取率的操作有___________ (列举两项)。
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是___________ 。
(4)酸浸后Ti以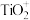 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为___________ 。
(5)“沉钒”中析出 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是___________ 。
(6)向10mL0.1mol/L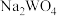 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使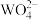 浓度小于
浓度小于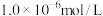 ,则
,则 溶液的最小浓度为
溶液的最小浓度为___________ mol/L。
(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式___________ 。
 催化剂(含
催化剂(含 、
、 、
、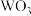 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。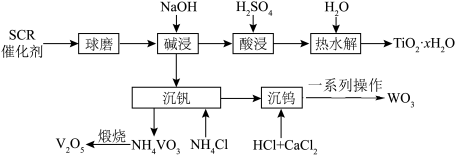
 、
、 和
和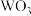 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的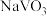 、
、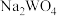 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③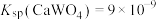 。
。回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:
(2)碱浸步骤可以提高浸取率的操作有
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是
(4)酸浸后Ti以
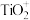 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为(5)“沉钒”中析出
 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是(6)向10mL0.1mol/L
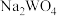 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使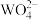 浓度小于
浓度小于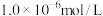 ,则
,则 溶液的最小浓度为
溶液的最小浓度为(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】KIO3是常见的食盐加碘剂,某小组制备KIO3晶体的流程如下,请回答下列问题:

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为___________ 。
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是___________ (填字母)。
a. b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是___________ 。
(4)步骤⑧后,往滤液中加入一定量___________ ,再次抽滤,可提高产品收率。
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②KIO3在酸性条件下氧化KI的离子方程式为___________ 。
③产品的质量分数为___________ (保留4位有效数字)。
④在确认滴定操作无误的情况下,质量分数异常的原因可能是___________ 。

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是
a.
 b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
(4)步骤⑧后,往滤液中加入一定量
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②KIO3在酸性条件下氧化KI的离子方程式为
③产品的质量分数为
④在确认滴定操作无误的情况下,质量分数异常的原因可能是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、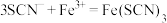 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
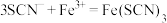 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为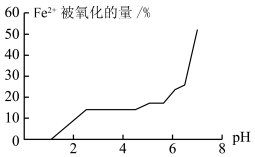
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取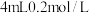 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴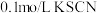 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴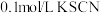 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为 2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________ 0(填“>”或“<”)。

②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________ mol/(L·s);第2s时的X值范围_________________________ 。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
则 CH4 脱硝的热化学方程式为 CH4 (g) + 4NO (g) CO2 (g) + 2N2 (g) + 2H2O (l)ΔH=
CO2 (g) + 2N2 (g) + 2H2O (l)ΔH=_________ kJ/mol(用 a、b 表示);平衡常数 K3=_________ (用 K1、K2 表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤 和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2 + H2O=NaHCO3 + NH3↑,用 H2O2 处理 1mol NaCN 时,反应中转移电子的物质的量为_________ mol(NaCN 中 C 为+2 价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为 0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI 呈黄色,且 CN-优先与 Ag+反应。
③实验如下:取 30.00mL 处理后的氰化钠废水于锥形瓶中,并滴加几滴 KI 溶液作指示剂, 用 1.000×10-4 mol/L 的 AgNO3 标准溶液滴定,消耗 AgNO3 溶液的体积为 1.50 mL。
④滴定终点的判断方法是_________ 。
⑤经计算处理后的废水中NaCN的浓度为_________ mg/L(保留两位小数),处理后的废水是否达到排放标准:________ (填“是”或“否”)
III.工业废水中,含有 NaNO2。NaNO2 固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出 在酸性条件下转化为氮气的电极反应式为
在酸性条件下转化为氮气的电极反应式为_____________ 。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为 2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH

②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
| 反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
| CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
| N2(g)+O2(g)═2NO(g) | b | K2 |
则 CH4 脱硝的热化学方程式为 CH4 (g) + 4NO (g)
 CO2 (g) + 2N2 (g) + 2H2O (l)ΔH=
CO2 (g) + 2N2 (g) + 2H2O (l)ΔH=II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤 和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2 + H2O=NaHCO3 + NH3↑,用 H2O2 处理 1mol NaCN 时,反应中转移电子的物质的量为
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为 0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI 呈黄色,且 CN-优先与 Ag+反应。
③实验如下:取 30.00mL 处理后的氰化钠废水于锥形瓶中,并滴加几滴 KI 溶液作指示剂, 用 1.000×10-4 mol/L 的 AgNO3 标准溶液滴定,消耗 AgNO3 溶液的体积为 1.50 mL。
④滴定终点的判断方法是
⑤经计算处理后的废水中NaCN的浓度为
III.工业废水中,含有 NaNO2。NaNO2 固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的
 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出 在酸性条件下转化为氮气的电极反应式为
在酸性条件下转化为氮气的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g) 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
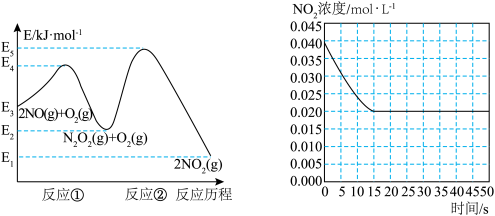
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________ 。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是____ (填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____ (反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______ ;该温度下反应2NO+O2 2NO2的化学平衡常数K为
2NO2的化学平衡常数K为_____ 。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____ (填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________ 。
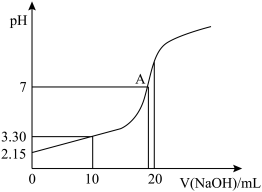
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____ 。
 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
 2NO2(g)反应速率的是
2NO2(g)反应速率的是(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为
 2NO2的化学平衡常数K为
2NO2的化学平衡常数K为(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】氯化亚砜用于医药、农药、染料工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=____________ 。
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是_____ 。
(2)如图是某同学测定上述反应平衡常数的对数值(lgK)与温度的变化关系点.

A点的数值为_____ 。(已知:lg4=0.6)
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=﹣4kJ•mol﹣1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为_____ kJ。
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为________________ ,电解质中锂离子定向移向_____ 极(填“正极”或“负极”).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应平衡常数的对数值(lgK)与温度的变化关系点.

A点的数值为
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=﹣4kJ•mol﹣1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_______ 。在一定条件下氨的平衡含量如表:
①该反应为_______ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是____________ 。
②M、N、Q点平衡常数K的大小关系是______________ 。
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为_______ 。

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2NO(g) N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol
请写出NH3转化为NO的热化学方程式_______ 。
(1)反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(2)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(3)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(4)NH3转化为NO是工业制取硝酸的重要一步。已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH=—1268kJ/mol
2N2(g)+6H2O(g) ΔH=—1268kJ/mol2NO(g)
 N2(g)+O2(g) ΔH=—180.5kJ/mol
N2(g)+O2(g) ΔH=—180.5kJ/mol请写出NH3转化为NO的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
①NaHA溶液的pH_____ Na2A溶液的pH(填大于、小于或等于)。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L的KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是_____________ 。
A.c(H+).c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(2)常温下,若在0.1mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________ (Ksp[Cu(OH)2]=2.2×10-20)。
(3)将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=____ ,则H2(g)+I2(g) 2HI(g)平衡常数的表达式为K1=
2HI(g)平衡常数的表达式为K1=_____ (用K表示).
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为_______ ,HI的分解率为______ 。
③能判断该反应达到平衡状态的依据是______
A.容器中压强不变 B.混合气体中c(HI)不变 C.c(I2)=c(H2) D.v(I2)正=v(H2)逆
(4)若该反应800℃达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2mol/L,c(I2)=1mol/L,c(H2)=1mol/L,则该时刻,反应向______ (填“正向”或“逆向”,下同)进行,若升高温度,反应向______ 进行。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。
H++A2-。①NaHA溶液的pH
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L的KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是
A.c(H+).c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(2)常温下,若在0.1mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
(3)将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)
 H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0①该反应平衡常数的表达式为K=
 2HI(g)平衡常数的表达式为K1=
2HI(g)平衡常数的表达式为K1=②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为
③能判断该反应达到平衡状态的依据是
A.容器中压强不变 B.混合气体中c(HI)不变 C.c(I2)=c(H2) D.v(I2)正=v(H2)逆
(4)若该反应800℃达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2mol/L,c(I2)=1mol/L,c(H2)=1mol/L,则该时刻,反应向
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】2021年6月17日我国自主研发的神舟十二号飞船进入太空,改进型火箭推进剂之一为无色气体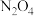 。已知
。已知 和
和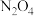 的结构式分别是
的结构式分别是 和
和 。实验测得N-N键的键能为
。实验测得N-N键的键能为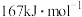 ,
, 中氮氧键的键能为
中氮氧键的键能为 ,
,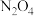 中氮氧键的键能为
中氮氧键的键能为 。
。
(1)写出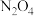 转化为
转化为 的热化学方程式
的热化学方程式_______ 。
(2)在100℃时,将0.40mol的 气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据。
气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据。
平衡常数 可用反应体系中气体物质分压表示(即
可用反应体系中气体物质分压表示(即 ),表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:
),表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如: ]。设反应开始时体系压强为
]。设反应开始时体系压强为 ,反应
,反应 ,平衡时各组分压强关系表达的平衡常数
,平衡时各组分压强关系表达的平衡常数 ,则
,则
_______ ;20~40s内, 的平均反应速率为
的平均反应速率为_______  。
。
(3)反应 ,一定条件下
,一定条件下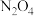 与
与 的
的消耗速率 与自身压强间存在: ,
,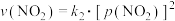 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是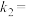
_______ 。
(4)将一定量的 充入注射器中后封口,下图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_______。
充入注射器中后封口,下图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_______。

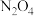 。已知
。已知 和
和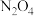 的结构式分别是
的结构式分别是 和
和 。实验测得N-N键的键能为
。实验测得N-N键的键能为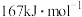 ,
, 中氮氧键的键能为
中氮氧键的键能为 ,
,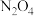 中氮氧键的键能为
中氮氧键的键能为 。
。(1)写出
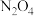 转化为
转化为 的热化学方程式
的热化学方程式(2)在100℃时,将0.40mol的
 气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据。
气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据。| 时间/s | 0 | 20 | 40 | 60 | 80 |
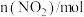 | 0.40 | n1 | 0.26 | n3 | n4 |
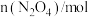 | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 可用反应体系中气体物质分压表示(即
可用反应体系中气体物质分压表示(即 ),表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:
),表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如: ]。设反应开始时体系压强为
]。设反应开始时体系压强为 ,反应
,反应 ,平衡时各组分压强关系表达的平衡常数
,平衡时各组分压强关系表达的平衡常数 ,则
,则
 的平均反应速率为
的平均反应速率为 。
。(3)反应
 ,一定条件下
,一定条件下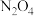 与
与 的
的 ,
,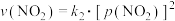 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是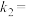
(4)将一定量的
 充入注射器中后封口,下图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_______。
充入注射器中后封口,下图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_______。
A.d点: |
| B.b点的操作是压缩注射器 |
C.c点与a点相比,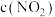 增大, 增大,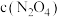 减小 减小 |
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数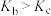 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】砷(As)是一种重要的非金属元素,常用于农药、杀虫剂等领域。
(1)亚砷酸(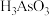 )可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。
)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。

①人体血液的pH在7.35~7.45之间,用药后人体中含砷元素的主要微粒是___________ 。
②结合化学用语解释 溶液显碱性的原因
溶液显碱性的原因___________ 。
③下列说法不正确的是___________ (填字母)。
a.对于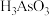 的电离平衡常数,有
的电离平衡常数,有
b.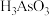 溶液中:
溶液中:
c. 溶液中:
溶液中:
(2)三价砷[As(III)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水:向废水中先加入适量漂白粉氧化(pH约为8),再加入生石灰将砷元素转化为 沉淀。
沉淀。
资料:a. ,溶液中离子浓度
,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;
b.一定条件下,As(V)的存在形式如下表所示:
i.加入生石灰的作用是___________ 。
ii.当除去 时,溶液中的
时,溶液中的 至少为
至少为___________  。
。
②工业含砷(III)废水常用铁盐处理后排放,其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物,经测定不同pH条件下铁盐对含砷(III)化合物的去除率如图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物,经测定不同pH条件下铁盐对含砷(III)化合物的去除率如图所示。

i.由图可得出的结论是___________ 。
ii.10min时,不同pH溶液中砷(III)的去除率不同,其原因是___________ 。
(1)亚砷酸(
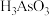 )可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。
)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。
①人体血液的pH在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
②结合化学用语解释
 溶液显碱性的原因
溶液显碱性的原因③下列说法不正确的是
a.对于
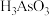 的电离平衡常数,有
的电离平衡常数,有
b.
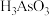 溶液中:
溶液中:
c.
 溶液中:
溶液中:
(2)三价砷[As(III)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水:向废水中先加入适量漂白粉氧化(pH约为8),再加入生石灰将砷元素转化为
 沉淀。
沉淀。资料:a.
 ,溶液中离子浓度
,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;b.一定条件下,As(V)的存在形式如下表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 |  |  |  |  、 、 |
i.加入生石灰的作用是
ii.当除去
 时,溶液中的
时,溶液中的 至少为
至少为 。
。②工业含砷(III)废水常用铁盐处理后排放,其原理是:铁盐混凝剂在溶液中产生
 胶粒,其表面带有正电荷,可吸附含砷化合物,经测定不同pH条件下铁盐对含砷(III)化合物的去除率如图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物,经测定不同pH条件下铁盐对含砷(III)化合物的去除率如图所示。
i.由图可得出的结论是
ii.10min时,不同pH溶液中砷(III)的去除率不同,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________ mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________ mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
(4)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(5)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
(6)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)、c(N2)、c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________
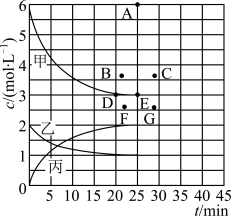
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(2)丙组实验混合溶液中离子浓度由大到小的顺序是
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
 2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(5)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 | B.3v正(N2)=v逆(H2) |
| C.容器内压强保持不变 | D.混合气体的密度保持不变 |

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____ 。
②浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4.则四种溶液中H+浓度由大到小的顺序为_____ 。
(2)常温时,C和CO的标准燃烧热分别为−394.0kJ·mol−1、−283.0kJ·mol−1,该条件下C转化为CO的热化学方程式为_____ 。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g) CH3OH(g) ΔH=QkJ·mol−1
CH3OH(g) ΔH=QkJ·mol−1
①该反应在不同温度下的化学平衡常数(K)如下表:
②一定温度下,将6molH2和2molCO充入体积为2L的密闭容器中,10min反应达到平衡状态,此时测得c(CO)=0.2mol·L−1,该温度下的平衡常数K=_____ ,0~10min内反应速率。
③在两个密闭容器中分别都充入20molH2和10molCO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20L,则B点对应容器的容积为_____ L。
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
| H2CO3 | H2C2O4 | |
| K1 | 4.2×10−7 | 5.4×10−2 |
| K2 | 5.6×10−11 | 5.4×10−5 |
②浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4.则四种溶液中H+浓度由大到小的顺序为
(2)常温时,C和CO的标准燃烧热分别为−394.0kJ·mol−1、−283.0kJ·mol−1,该条件下C转化为CO的热化学方程式为
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)
 CH3OH(g) ΔH=QkJ·mol−1
CH3OH(g) ΔH=QkJ·mol−1①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 300 | 350 |
| K/L2·mol−2 | 2.041 | 0.270 | 0.012 |
③在两个密闭容器中分别都充入20molH2和10molCO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20L,则B点对应容器的容积为
您最近一年使用:0次



