1 . t℃时,将一定浓度的 溶液分别滴加到一定浓度的KOH、
溶液分别滴加到一定浓度的KOH、 溶液中,所得沉淀的溶解平衡曲线如图所示。已知
溶液中,所得沉淀的溶解平衡曲线如图所示。已知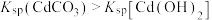 ,
,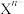 代表
代表 或
或 。下列说法错误的是
。下列说法错误的是
 溶液分别滴加到一定浓度的KOH、
溶液分别滴加到一定浓度的KOH、 溶液中,所得沉淀的溶解平衡曲线如图所示。已知
溶液中,所得沉淀的溶解平衡曲线如图所示。已知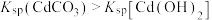 ,
,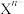 代表
代表 或
或 。下列说法错误的是
。下列说法错误的是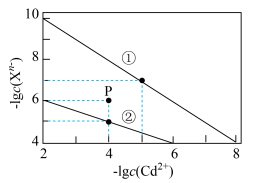
A.曲线②对应的沉淀是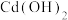 |
B.P点: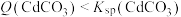 |
C.向浓度均为0.001 的KOH与 的KOH与 混合溶液中滴加 混合溶液中滴加 溶液,先析出 溶液,先析出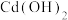 |
D.t℃时,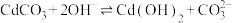 的K=100 的K=100 |
您最近一年使用:0次
2 . 常温下,向含有 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示。pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示。pM表示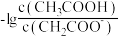 或
或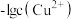 或
或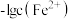 。当溶液中pM>5时可认为该离子沉淀完全。已知:
。当溶液中pM>5时可认为该离子沉淀完全。已知: ;
;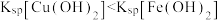 。下列说法错误的是
。下列说法错误的是
 、
、 、
、 的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示。pM表示
的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示。pM表示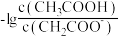 或
或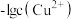 或
或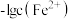 。当溶液中pM>5时可认为该离子沉淀完全。已知:
。当溶液中pM>5时可认为该离子沉淀完全。已知: ;
;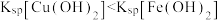 。下列说法错误的是
。下列说法错误的是
A.③表示pFe与pH的关系,且 |
B.pH=4时,溶液中 |
C.pH=7时,可认为 沉淀完全 沉淀完全 |
D.pH<9时,溶液中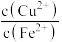 恒等于 恒等于 |
您最近一年使用:0次
3 . 秦俑彩绘中含有难溶的 (白色固体)和
(白色固体)和 (黄色固体)。常温下,
(黄色固体)。常温下, 和
和 达到沉淀溶解平衡时,阳离子浓度的负对数pM与阴离子浓度的负对数pR的关系如图所示,下列说法错误的是
达到沉淀溶解平衡时,阳离子浓度的负对数pM与阴离子浓度的负对数pR的关系如图所示,下列说法错误的是

 (白色固体)和
(白色固体)和 (黄色固体)。常温下,
(黄色固体)。常温下, 和
和 达到沉淀溶解平衡时,阳离子浓度的负对数pM与阴离子浓度的负对数pR的关系如图所示,下列说法错误的是
达到沉淀溶解平衡时,阳离子浓度的负对数pM与阴离子浓度的负对数pR的关系如图所示,下列说法错误的是
A.向z点对应溶液中加入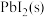 ,可以继续溶解 ,可以继续溶解 |
B.反应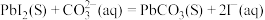 的化学平衡常数 的化学平衡常数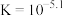 |
C.向浓度均为 的 的 与 与 混合溶液中缓慢滴加 混合溶液中缓慢滴加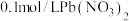 溶液,先产生白色沉淀 溶液,先产生白色沉淀 |
| D.向y点对应溶液中加入对应阴离子的固态钠盐,y点向w点移动 |
您最近一年使用:0次
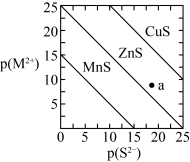
4 . 已知:一定温度下, 。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
 。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.a点有 沉淀生成 沉淀生成 |
B.可用 除去 除去 溶液中混有的少量 溶液中混有的少量 |
C.向 悬浊液中加入少量水,平衡向溶解的方向移动, 悬浊液中加入少量水,平衡向溶解的方向移动, 减小 减小 |
D. 和 和 共存的悬浊液中, 共存的悬浊液中, |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是


| A.T1<T2 |
| B.加入BaCl2固体,可使溶液由a点变到c点 |
| C.c点时,在T1温度下有固体析出 |
| D.图中c点对应的是T1时硫酸钡的过饱和溶液 |
您最近一年使用:0次
23-24高二·全国·假期作业
解题方法
6 . 已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:K2SO4·MgSO4·2CaSO4 (s) 2Ca2++2K++ Mg2+ +4SO
2Ca2++2K++ Mg2+ +4SO ,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是

 2Ca2++2K++ Mg2+ +4SO
2Ca2++2K++ Mg2+ +4SO ,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
| A.向该体系中加入饱和NaOH溶液,溶解平衡向左移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO ) ) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
您最近一年使用:0次
7 . 秦俑彩绘中含有难溶的 和
和 。常温下,
。常温下, 和
和 达到沉淀溶解平衡时,阳离子浓度的负对数
达到沉淀溶解平衡时,阳离子浓度的负对数 与阴离子浓度的负对数
与阴离子浓度的负对数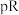 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是

 和
和 。常温下,
。常温下, 和
和 达到沉淀溶解平衡时,阳离子浓度的负对数
达到沉淀溶解平衡时,阳离子浓度的负对数 与阴离子浓度的负对数
与阴离子浓度的负对数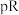 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是
A. 代表为 代表为 的沉淀溶解平衡曲线 的沉淀溶解平衡曲线 |
B.反应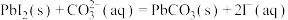 的化学平衡常数 的化学平衡常数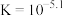 |
C.向 点对应溶液中加入 点对应溶液中加入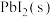 ,可以继续溶解 ,可以继续溶解 |
D.向 点对应溶液中加入对应阴离子的固态钠盐, 点对应溶液中加入对应阴离子的固态钠盐, 点向 点向 点移动 点移动 |
您最近一年使用:0次
2023-12-03更新
|
293次组卷
|
2卷引用:山东省日照市2023-2024学年高二上学期期中校际联合考试化学试题
8 . 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM= - lgc(阴离子)、pN= - lgc(阳离子)。下列说法错误的是


| A.a线是CaSO4沉淀溶解平衡曲线 |
B.d点表示CaCO3的饱和溶液,且c(Ca2+)>c( ) ) |
C.T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中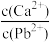 =3×10-5 =3×10-5 |
| D.T℃时,向CaCO3沉淀中加入1mol•L-1的Na2SO4溶液,CaCO3沉淀会转化为CaSO4沉淀 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
9 . 下列有关AgCl沉淀溶解平衡的说法中,不正确的是
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl悬浊液中加入NaCl固体,AgCl的溶解度增大 |
您最近一年使用:0次
10 . 利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:ⅰ、图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ、图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c( )=Ksp(MgCO3);
)=Ksp(MgCO3);
[注:起始c(Na2CO3)=0.1mol·L−1,不同pH下c( )由图1得到]。
)由图1得到]。
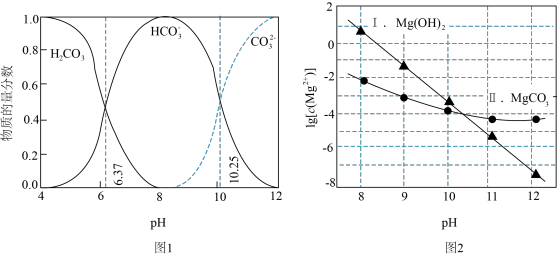
下列说法正确的是
已知:ⅰ、图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ、图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(
 )=Ksp(MgCO3);
)=Ksp(MgCO3);[注:起始c(Na2CO3)=0.1mol·L−1,不同pH下c(
 )由图1得到]。
)由图1得到]。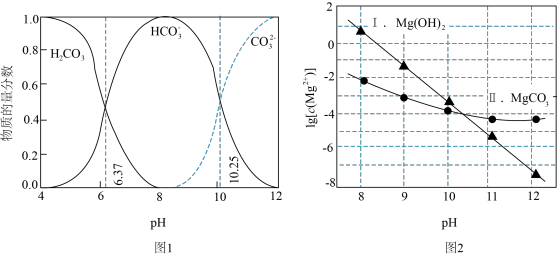
下列说法正确的是
A.由图1,pH=10.25,c( )=c( )=c( ) ) |
| B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,有沉淀生成 |
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在:c(H2CO3)+c( )+c( )+c( )=0.1mol·L−1 )=0.1mol·L−1 |
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2 =MgCO3↓+CO2↑+H2O =MgCO3↓+CO2↑+H2O |
您最近一年使用:0次
2023-09-18更新
|
173次组卷
|
2卷引用: 山东省泰安肥城市2023-2024学年高三9月阶段测试化学试题



