名校
解题方法
1 . 以硫化铜精矿为原料生产CuCl的工艺过程如下:

已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________ ,溶解温度应控制在60—70℃,原因是_____________ 。
(3)写出步骤③中主要反应的离子方程式_____________ 。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因_____________ 。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________ (写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________ 。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为
为_____________ 。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)

已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式
(2)步骤①中得到的氧化产物是
(3)写出步骤③中主要反应的离子方程式
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(6)上述工艺中,步骤⑥不能省略,理由是
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
 为
为
您最近一年使用:0次
名校
解题方法
2 . 第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数 的元素,其原子结构示意图为
的元素,其原子结构示意图为________________ ;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________ 。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
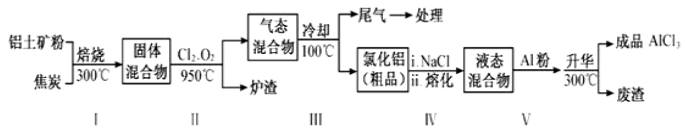
已知:
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________ 。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________ 。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________ ;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________ 。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________ 。
(1)原子最外层电子数是核外电子总数
 的元素,其原子结构示意图为
的元素,其原子结构示意图为(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:

在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式
(3)氯化铝的水溶液可用于净水,其原因是
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是
您最近一年使用:0次
名校
解题方法
3 . 锰及其化合物间的转化如图。

请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:_____ 。
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为_____ 。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当____ ,表明达到滴定终点。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=_____ 。
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是____ (填“Fe”或“C”),该电极的产物使碱性污水中MnO4-转化为沉淀除去的离子方程式为____ 。
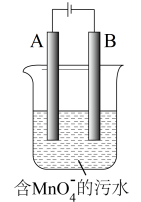

请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是

您最近一年使用:0次
解题方法
4 . 某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
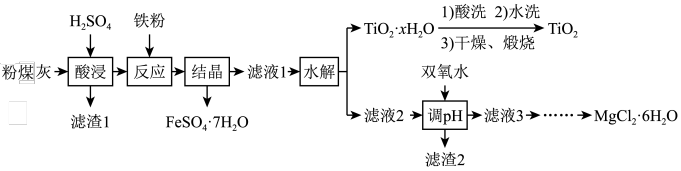
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为_______________ 。
(2)“反应”时加入铁粉的作用为_______________ 。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为_____________ 。
(4)“水解”反应的离子方程式为______________ 。所得TiO2•xH2O 沉淀进行酸洗的目的为____________ 。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为________ 。
(6)实验室用MgCl2溶液制备MgCl2•6H2O,需进行的操作为_____ 、降温结晶、过滤、洗涤、干燥。
(7)FeSO4•7H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO4•7H2O的质量分数为____ (用代数式表示)。

已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为
(2)“反应”时加入铁粉的作用为
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为
(4)“水解”反应的离子方程式为
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为
(6)实验室用MgCl2溶液制备MgCl2•6H2O,需进行的操作为
(7)FeSO4•7H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO4•7H2O的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
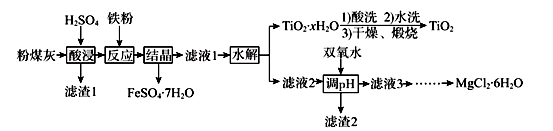
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________ 。怎样判断TiO2•xH2O沉淀已经洗涤干净____________________________________________ 。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________ 。滤渣2成分为________________ 。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________ 。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl2•6H2O应注意_____________________________________ 。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________ 。

已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有
(2)“水解”反应的离子方程式为
(3)加入双氧水调节溶液pH时离子方程式为
(4)滤液3在蒸发结晶制备MgCl2•6H2O应注意
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为
您最近一年使用:0次
2018-05-04更新
|
215次组卷
|
2卷引用:广西南宁市第三中学2017-2018学年高二下学期期中考试化学试题
解题方法
6 . 四氧化三锰(Mn3O4)是电子工业的磁性材料,而氯化铅(PbCl2)常用于焊料和助溶剂、制备其他铅盐等。用方铅矿精矿(主要成分为PbS)和软锰矿(主要成分是MnO2,还含有Fe2O3、Al2O3等杂质)制备PbCl2和Mn3O4的工艺流程如下:

已知:PbCl2(s) + 2Cl-(aq)
 ( aq) ΔH > 0
( aq) ΔH > 0
(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有________ (写出一条即可)。
(2)试剂X是___________ 。(填“化学式”)
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为___________ 。
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是___________ 。
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为___________ 。
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn时,理论上消耗金属铝的质量最少为___________ kg。

已知:PbCl2(s) + 2Cl-(aq)

 ( aq) ΔH > 0
( aq) ΔH > 0(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有
(2)试剂X是
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn时,理论上消耗金属铝的质量最少为
您最近一年使用:0次
名校
解题方法
7 . 二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________ 。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________ ;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________ ,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________ 。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________ 。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________ 。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O ===2I-+S4O
===2I-+S4O )。计算可得该样品纯度为
)。计算可得该样品纯度为_____________ 。(保留一位小数)

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-31 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能
(3)滤渣B的成分是
(4)碱性锌锰电池中,MnO2参与的电极反应式为
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O
 ===2I-+S4O
===2I-+S4O )。计算可得该样品纯度为
)。计算可得该样品纯度为
您最近一年使用:0次
解题方法
8 . 金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:

已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)FeS2中S元素的化合价为_____ 价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________ (用离子方程式表示)。
(4)调节pH的最佳范围是_______ ,沉淀的成分是______ (填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__ NA。
(6)工业上采用如图所示的方法获得金属Mn,B极为____ 极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________ 。


已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
| Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
| pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
| pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:
(3)向浸出液中吹入空气的目的是
(4)调节pH的最佳范围是
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为
(6)工业上采用如图所示的方法获得金属Mn,B极为

您最近一年使用:0次
解题方法
9 . 镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是__________________ 。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

该工艺中可循环使用的物质有______________ 。
(3)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2=MgH2+2Al+3H2↑,每转移6 mol电子生成氢气的物质的量为________ mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000 g产品用适量硝酸溶解,经稀释等步骤最终配得500 mL的溶液。
a.准确量取25.00 mL 待测液,用0.100 0 mol/L AgNO3标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为________ mL。

b.
参照上表数据及信息分析,滴定时可以作指示剂的是________ (填数字序号)。
①CaCl2 ②NaBr ③NaI ④K2CrO4
(1)镁在元素周期表中的位置是
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

该工艺中可循环使用的物质有
(3)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2=MgH2+2Al+3H2↑,每转移6 mol电子生成氢气的物质的量为
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000 g产品用适量硝酸溶解,经稀释等步骤最终配得500 mL的溶液。
a.准确量取25.00 mL 待测液,用0.100 0 mol/L AgNO3标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为

b.
| AgCl | AgBr | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 淡黄 | 黄 | 砖红 |
①CaCl2 ②NaBr ③NaI ④K2CrO4
您最近一年使用:0次
解题方法
10 . 镁及其化合物在生产、生活中应用广泛。
Ⅰ.(1)镁在元素周期表中的位置为___________
(2)镁的碳化物常见的有MgC2和Mg2C3两种,可分别发生水解反应生成乙炔和丙二烯,写出MgC2水解反应的方程式为_________ ;Mg2C3的电子式为_________ .
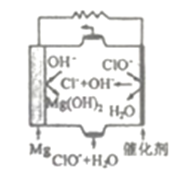
(3)由Mg可制成“镁一次氯酸盐”燃料电池,其装置示意图如下图所示,该电池反应的离子方程式为____________ .
Ⅱ.利用氯碱工业盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下图所示。

(4)酸浸时,FeCO3与硫酸反应的化学方程式为_____________ ,为了提高浸取率可采取的措施有_____ (填字母)。
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.适当延长浸取时间
(5)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子程式为______________ ;滤渣2为MnO2和_____________ 、___________ (填化学式)。
Ⅰ.(1)镁在元素周期表中的位置为
(2)镁的碳化物常见的有MgC2和Mg2C3两种,可分别发生水解反应生成乙炔和丙二烯,写出MgC2水解反应的方程式为
(3)由Mg可制成“镁一次氯酸盐”燃料电池,其装置示意图如下图所示,该电池反应的离子方程式为

Ⅱ.利用氯碱工业盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下图所示。

(4)酸浸时,FeCO3与硫酸反应的化学方程式为
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.适当延长浸取时间
(5)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子程式为
您最近一年使用:0次



