名校
1 . 工业上以侯氏制碱法为基础生产焦亚硫酸钠( )的工艺流程如下:
)的工艺流程如下:

(1)反应1的化学方程式为___________ ;在进行反应时,向 溶液中先通入
溶液中先通入___________ (填“ ” 或“
” 或“ ”);
”);
(2)已知“灼烧时会生成 ,则其化学方程式为
,则其化学方程式为___________ ;
(3)已知 与稀硫酸反应会生成
与稀硫酸反应会生成 ,则其离子方程式为
,则其离子方程式为___________ ;
(4)副产品X化学式为___________ ;该生产中可循环利用的物质为___________ (化学式)。
(5)为了减少产品 中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为
中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为___________ 。
 )的工艺流程如下:
)的工艺流程如下:
(1)反应1的化学方程式为
 溶液中先通入
溶液中先通入 ” 或“
” 或“ ”);
”);(2)已知“灼烧时会生成
 ,则其化学方程式为
,则其化学方程式为(3)已知
 与稀硫酸反应会生成
与稀硫酸反应会生成 ,则其离子方程式为
,则其离子方程式为(4)副产品X化学式为
(5)为了减少产品
 中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为
中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为
您最近一年使用:0次
2023-11-04更新
|
1059次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高一上学期期中考试化学试题
2 . 填空。
(1)写出表示含有8个质子,10个中子的原子的化学符号:_______ 。
(2)根据下列微粒回答问题: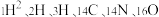 。
。
①以上6种微粒共有_______ 种核素,_______ 种元素。
②互为同位素的是_______ 。
③质量数相等的是_______ ,中子数相等的是_______ 。
(3)相同物质的量的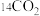 与
与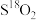 的质量之比为
的质量之比为_______ ;中子数之比为_______ ;电子数之比为_______ 。
(4)质量相同的 和
和 与足量钠反应,放出的气体在标准状况下的体积之比为
与足量钠反应,放出的气体在标准状况下的体积之比为_______ 。
(1)写出表示含有8个质子,10个中子的原子的化学符号:
(2)根据下列微粒回答问题:
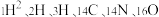 。
。①以上6种微粒共有
②互为同位素的是
③质量数相等的是
(3)相同物质的量的
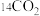 与
与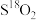 的质量之比为
的质量之比为(4)质量相同的
 和
和 与足量钠反应,放出的气体在标准状况下的体积之比为
与足量钠反应,放出的气体在标准状况下的体积之比为
您最近一年使用:0次
2022-08-17更新
|
1016次组卷
|
2卷引用:辽宁省铁岭市昌图县第一高级中学2022-2023学年高一上学期12月化学试题
解题方法
3 . 元素周期表的发现是近现代化学理论诞生的标志,全世界几乎所有化学教科书后都附有元素周期表。下表为元素周期表的一部分,请回答下列有关问题。
(1)由元素①和④可形成四核 的分子,写出该分子的电子式
的分子,写出该分子的电子式_______ 。
(2)元素④和⑤可构成一种淡黄色固体化合物,写出该化合物与②的最高价氧化物反应的化学方程式_______ 。
(3)元素②、③、④简单氢化物的稳定性由高到低顺序为_______ (用化学式表示)。
(4)元素⑦、⑧、⑨的简单离子半径由大到小顺序为_______ (用离子符号表示)。
(5)写出单质⑥与元素⑤的最高价氧化物对应水化物反应的化学方程式_______ 。
(6)元素的非金属性:⑧_______ ⑩(填“>”或“<”),下列事实不能说明上述结论的是_______ 。
A.元素⑧的单质与⑩的氢化物的水溶液发生反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
F.常温下单质⑧为气态,单质⑩为液态
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 的分子,写出该分子的电子式
的分子,写出该分子的电子式(2)元素④和⑤可构成一种淡黄色固体化合物,写出该化合物与②的最高价氧化物反应的化学方程式
(3)元素②、③、④简单氢化物的稳定性由高到低顺序为
(4)元素⑦、⑧、⑨的简单离子半径由大到小顺序为
(5)写出单质⑥与元素⑤的最高价氧化物对应水化物反应的化学方程式
(6)元素的非金属性:⑧
A.元素⑧的单质与⑩的氢化物的水溶液发生反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
F.常温下单质⑧为气态,单质⑩为液态
您最近一年使用:0次
2023-01-04更新
|
731次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
4 . 在常温常压下,有以下10种物质,请回答下列问题:
①干冰;②熔融氧化钠;③蔗糖;④稀硫酸;⑤NaHSO4溶液;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧铜
(1)其中能导电的是___________ (填写序号,下同);属于电解质的是___________ ;属于非电解质的是___________ 。
(2)写出物质⑦的电离方程式:___________ 。
(3)写出物质④和⑦反应的离子方程式:___________ 。
(4)写出物质④和⑥在水中发生反应的离子方程式:________ 。
①干冰;②熔融氧化钠;③蔗糖;④稀硫酸;⑤NaHSO4溶液;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧铜
(1)其中能导电的是
(2)写出物质⑦的电离方程式:
(3)写出物质④和⑦反应的离子方程式:
(4)写出物质④和⑥在水中发生反应的离子方程式:
您最近一年使用:0次
2023-07-10更新
|
699次组卷
|
4卷引用: 辽宁省阜新市第二高级中学2023-2024学年高一上学期第一次考试化学试卷
名校
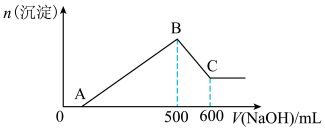
5 . Ⅰ.将18g镁铝合金溶于250mL 4mol/L硫酸溶液中充分反应,共产生V L(标准状况)气体,向反应后的溶液中逐滴滴加某浓度的氢氧化钠溶液至过量,产生沉淀的物质的量与加入氢氧化钠溶液体积关系如下图所示(图像三个拐点分别标记为A、B、C),根据题意和图示回答下列问题。___________ 。
(2)氢氧化钠溶液的浓度为___________ mol/L。
(3)原合金中镁的质量是___________ g。
(4)V=___________ 。
Ⅱ.已知硝酸与金属发生反应时,随着硝酸浓度的下降,还原产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种。 某同学取一定量的铝铁合金与500 mL很稀的硝酸充分反应,反应过程中无气体放出。向反应结束后的溶液中逐滴加入l mo/L NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:___________ 。
(6)合金中铝和铁的物质的量比为___________ 。
(7)A点对应的氢氧化钠溶液的体积为___________ mL。
(8)上述很稀的硝酸的浓度为___________ mo1/L。
(2)氢氧化钠溶液的浓度为
(3)原合金中镁的质量是
(4)V=
Ⅱ.已知硝酸与金属发生反应时,随着硝酸浓度的下降,还原产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种。 某同学取一定量的铝铁合金与500 mL很稀的硝酸充分反应,反应过程中无气体放出。向反应结束后的溶液中逐滴加入l mo/L NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:

(6)合金中铝和铁的物质的量比为
(7)A点对应的氢氧化钠溶液的体积为
(8)上述很稀的硝酸的浓度为
您最近一年使用:0次
2023-12-15更新
|
648次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高一上学期12月化学试卷
辽宁省实验中学2023-2024学年高一上学期12月化学试卷(已下线)重难点01 浓硫酸、浓硝酸的性质与反应计算-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)安徽省合肥市第一中学肥东分校2023-2024学年高一上学期期末考试化学试卷
解题方法
6 . 请回答下列问题:
(1)已知某粒子的结构示意图为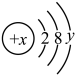 。试回答:
。试回答:
①当x-y=10时,该粒子为___________ (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填符号):___________ 、___________ 、___________ 、___________ 。
③写出y=1与y=6的元素最高价氧化物对应的水化物之间发生反应的离子方程式:___________ 。
(2)阿伏加德罗常数为NA,某元素的一种核素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子。ag HmX的物质的量为___________ ,所含中子的物质的量为___________ ,所含质子的数目为___________ 。
(1)已知某粒子的结构示意图为
 。试回答:
。试回答:①当x-y=10时,该粒子为
②当y=8时,粒子可能为(填符号):
③写出y=1与y=6的元素最高价氧化物对应的水化物之间发生反应的离子方程式:
(2)阿伏加德罗常数为NA,某元素的一种核素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子。ag HmX的物质的量为
您最近一年使用:0次
2021-12-09更新
|
1652次组卷
|
4卷引用:辽宁省沈阳市重点高中联合体2021-2022学年高一12月考试化学试题
辽宁省沈阳市重点高中联合体2021-2022学年高一12月考试化学试题专题八 原子结构与元素周期表(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)第四章 物质结构 元素周期律(已下线)专题突破卷05?物质结构 元素周期律?-2024年高考化学一轮复习考点通关卷(新教材新高考)
7 . 请回答下列问题:
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500mL“84消毒液”,并在试剂瓶上贴上如图所示标签。
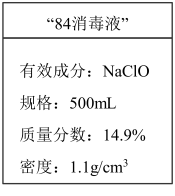
①该“84消毒液”有效成分的物质的量浓度为_______  。
。
②下列说法正确的有_______ 。
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
请写出pH降低时产生氯气的离子方程式_______ 。
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是_______ (填序号)。
①金属钠投入到 溶液中
溶液中
② 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合
③少量 投入过量
投入过量 溶液中
溶液中
④氯化钙溶液中通入少量的
⑤向饱和 溶液中通入足量
溶液中通入足量
⑥向 溶液中通入足量
溶液中通入足量 溶液
溶液
(3)汽车剧烈碰撞时安全气囊中发生如下反应: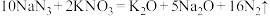 ,若氧化产物比还原产物多19.6g,则反应生成的
,若氧化产物比还原产物多19.6g,则反应生成的 在标况下的体积为
在标况下的体积为_______ L。
(4)某溶液可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为 )。
)。
①该溶液中肯定存在的离子有_______ 。
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有_______ 种。
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500mL“84消毒液”,并在试剂瓶上贴上如图所示标签。

①该“84消毒液”有效成分的物质的量浓度为
 。
。②下列说法正确的有
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
| 溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 | NaClO | HCl与NaClO(少量) | HCl与 (少量) (少量) | HClO与 |  |
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到
 溶液中
溶液中②
 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合③少量
 投入过量
投入过量 溶液中
溶液中④氯化钙溶液中通入少量的

⑤向饱和
 溶液中通入足量
溶液中通入足量
⑥向
 溶液中通入足量
溶液中通入足量 溶液
溶液(3)汽车剧烈碰撞时安全气囊中发生如下反应:
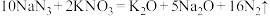 ,若氧化产物比还原产物多19.6g,则反应生成的
,若氧化产物比还原产物多19.6g,则反应生成的 在标况下的体积为
在标况下的体积为(4)某溶液可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为
 )。
)。①该溶液中肯定存在的离子有
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有
您最近一年使用:0次
2023-01-04更新
|
631次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
8 . A、B、M、D、E为短周期主族元素,且原子序数依次增大,质子数之和为39,B、M同周期,A、D同主族,A为短周期原子半径最小的元素,M原子最外层电子数为次外层的3倍,A、M常温下能形成两种液态化合物A2M和A2M2,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
(1)B元素在周期表中的位置为_________ ;由A、M、D三种元素组成的化合物中含有的化学键为_________ ;A2M分子的空间结构为_________ ;
(2)用电子式表示D2M的形成过程_________
(3)D、E、M形成的简单离子半径从大到小的顺序为_________ (用离子符号表示)
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出该反应的离子方程式___________ 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,且反应后的溶液呈碱性。若将0.1mol的DA和0.1mol的E单质混合后加入足量的水,充分反应后生成的气体在标准状况下的体积是___________ L。
(1)B元素在周期表中的位置为
(2)用电子式表示D2M的形成过程
(3)D、E、M形成的简单离子半径从大到小的顺序为
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出该反应的离子方程式
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,且反应后的溶液呈碱性。若将0.1mol的DA和0.1mol的E单质混合后加入足量的水,充分反应后生成的气体在标准状况下的体积是
您最近一年使用:0次
2022-03-04更新
|
818次组卷
|
2卷引用:辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题
名校
9 . 物质的类别和核心元素的化合价是学习研究物质性质的两个重要角度。根据硫元素的价类二维图回答下列问题:

(1)Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂,当Z作氧化剂时,理论上可被还原为_______ (填字母)。
A. B.
B. C.
C. D.
D. E.
E.
(2)X与Y反应可生成淡黄色固体,反应的化学方程式为_______ ,该反应中氧化产物与还原产物的物质的量之比为_______ 。
(3)W的浓溶液与铜单质在加热条件下发生反应的化学方程式为_______ ,反应中W表现的性质是_______ ,该反应中每转移 电子,生成标准状况下气体的体积为
电子,生成标准状况下气体的体积为_______ L。
(4)已知空气中 的最大允许排放浓度不得超过
的最大允许排放浓度不得超过 ,可通过下列装置定量分析空气中
,可通过下列装置定量分析空气中 的含量。
的含量。

该组同学查阅资料得知测定原理为 ,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为
,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为 ,则该地空气中的
,则该地空气中的 含量是
含量是_______  (结果精确到0.001)。
(结果精确到0.001)。

(1)Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂,当Z作氧化剂时,理论上可被还原为
A.
 B.
B. C.
C. D.
D. E.
E.
(2)X与Y反应可生成淡黄色固体,反应的化学方程式为
(3)W的浓溶液与铜单质在加热条件下发生反应的化学方程式为
 电子,生成标准状况下气体的体积为
电子,生成标准状况下气体的体积为(4)已知空气中
 的最大允许排放浓度不得超过
的最大允许排放浓度不得超过 ,可通过下列装置定量分析空气中
,可通过下列装置定量分析空气中 的含量。
的含量。
该组同学查阅资料得知测定原理为
 ,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为
,若从气体通入起计时直到广口瓶中溶液蓝色恰好褪去结束,用时9min。已知空气的流速为 ,则该地空气中的
,则该地空气中的 含量是
含量是 (结果精确到0.001)。
(结果精确到0.001)。
您最近一年使用:0次
2022-02-21更新
|
767次组卷
|
4卷引用:辽宁省沈阳市市级重点高中联合体2021-2022学年高一下学期期中测试化学试题
名校
10 . 有下列物质:① 固体;②熔融的
固体;②熔融的 ;③
;③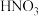 ;④稀硫酸;⑤
;④稀硫酸;⑤ ;⑥铜;⑦氨水;⑧蔗糖晶体;⑨
;⑥铜;⑦氨水;⑧蔗糖晶体;⑨ 固体
固体
(1)上述状态下的物质可导电的是_______ (填序号,下同)。
(2)属于强电解质的是_______ 。
(3)写出 在水溶液中的电离方程式:
在水溶液中的电离方程式:_______ 。
(4)写出用⑨制备 胶体的化学方程式:
胶体的化学方程式:_______ 。
(5)写出①的溶液与②的溶液恰好中和时的离子方程式:_______ 。
(6)⑥和③的稀溶液反应生成 和NO,写出该反应的化学方程式:
和NO,写出该反应的化学方程式:_______ ;该反应中体现氧化性和酸性的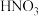 的个数比为
的个数比为_______ 。
 固体;②熔融的
固体;②熔融的 ;③
;③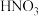 ;④稀硫酸;⑤
;④稀硫酸;⑤ ;⑥铜;⑦氨水;⑧蔗糖晶体;⑨
;⑥铜;⑦氨水;⑧蔗糖晶体;⑨ 固体
固体(1)上述状态下的物质可导电的是
(2)属于强电解质的是
(3)写出
 在水溶液中的电离方程式:
在水溶液中的电离方程式:(4)写出用⑨制备
 胶体的化学方程式:
胶体的化学方程式:(5)写出①的溶液与②的溶液恰好中和时的离子方程式:
(6)⑥和③的稀溶液反应生成
 和NO,写出该反应的化学方程式:
和NO,写出该反应的化学方程式: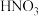 的个数比为
的个数比为
您最近一年使用:0次
2022-10-12更新
|
654次组卷
|
2卷引用:辽宁省沈阳市第一二〇中学2022-2023学年高一上学期第一次月考化学试题



