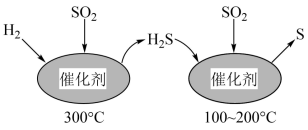
1 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成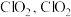 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
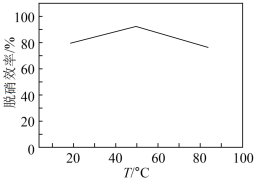
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为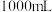 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成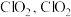 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度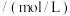 | 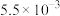 | 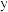 |  |  |  |
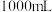 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近一年使用:0次
2 . 钠是一种常见元素,化学性质非常活泼,在工业生产和化工领域应用广泛。请回答下列问题:
(1)为了防止钠被空气中氧气氧化,可将钠保存在______ 中。
(2)钠有两种常见氧化物,分别是 、
、 ,其中可以作为供氧剂的是
,其中可以作为供氧剂的是______ 。
(3)钠的一种盐俗称苏打,其化学式为______ ,向该盐溶液中通入 气体,会生成
气体,会生成 ,写出该反应的化学方程式:
,写出该反应的化学方程式:______ 。
(4)钠的另外一种盐 在日常生活应用也十分广泛,既可以用来烘焙糕点,也可以用来治疗胃酸过多,它的俗名为
在日常生活应用也十分广泛,既可以用来烘焙糕点,也可以用来治疗胃酸过多,它的俗名为______ 。
(1)为了防止钠被空气中氧气氧化,可将钠保存在
(2)钠有两种常见氧化物,分别是
 、
、 ,其中可以作为供氧剂的是
,其中可以作为供氧剂的是(3)钠的一种盐俗称苏打,其化学式为
 气体,会生成
气体,会生成 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)钠的另外一种盐
 在日常生活应用也十分广泛,既可以用来烘焙糕点,也可以用来治疗胃酸过多,它的俗名为
在日常生活应用也十分广泛,既可以用来烘焙糕点,也可以用来治疗胃酸过多,它的俗名为
您最近一年使用:0次
解题方法
3 . 含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉[有效成分为Ca(ClO)2]、“84”消毒液(有效成分为NaClO)等。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有___ (填离子符号)。
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是___ (填字母序号)。
a.焰色反应
b.加入Na2CO3溶液
c.加入NaCl稀溶液
(3)①将“84”消毒液与洁厕剂(含有盐酸)混合,反应生成___ 气体(填化学式),能使人中毒。
②“84”消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:___ 。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是
a.焰色反应
b.加入Na2CO3溶液
c.加入NaCl稀溶液
(3)①将“84”消毒液与洁厕剂(含有盐酸)混合,反应生成
②“84”消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:
您最近一年使用:0次
2021-10-09更新
|
341次组卷
|
2卷引用:江苏省2021年普通高中学业水平合格性考试化学试题
名校
4 . 铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一、然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O=2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
(1)核素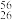 Fe的核外电子数是
Fe的核外电子数是_______
A. 56 B.30 C. 82 D. 26
(2)H和Na都属于元素周期表第ⅠA元素,它们原子结构中相同的是_______
A.最外层电子数 B.核外电子数 C.电子层数 D. 质子数
(3)判断O的非金属性比N强,不可依据的事实是_______
A.氨气在氧气中燃烧生成氮气 B.NO中N为+2价,O为-2价
C.沸点: H2O>NH3 D.热稳定性H2O>NH3
(4)硒位于元素周期表的第四周期第VIA族,关于硒元素性质推测正确的是_______
A.原子半径比硫小 B.最高化合价为+6
C.最高价氧化物的水化物酸性比硫的强 D. 常温常压硒的状态是液体
(1)核素
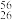 Fe的核外电子数是
Fe的核外电子数是A. 56 B.30 C. 82 D. 26
(2)H和Na都属于元素周期表第ⅠA元素,它们原子结构中相同的是
A.最外层电子数 B.核外电子数 C.电子层数 D. 质子数
(3)判断O的非金属性比N强,不可依据的事实是
A.氨气在氧气中燃烧生成氮气 B.NO中N为+2价,O为-2价
C.沸点: H2O>NH3 D.热稳定性H2O>NH3
(4)硒位于元素周期表的第四周期第VIA族,关于硒元素性质推测正确的是
A.原子半径比硫小 B.最高化合价为+6
C.最高价氧化物的水化物酸性比硫的强 D. 常温常压硒的状态是液体
您最近一年使用:0次
解题方法
5 . 舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,下列说法正确的是
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
 MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。(1)氯气和氢气的反应的属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,下列说法正确的是
MnCl2+Cl2↑+2H2O,下列说法正确的是A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
您最近一年使用:0次
6 . 请阅读下列材料,完成下面小题。
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
1. SO2与O2在一定条件下反应生成SO3,该反应属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是( )
A. O2是还原剂 B. SO2被氧化
C. O2失去电子 D. SO2发生还原反应
3. 上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是( )
A. 升高温度能减慢反应速率
B. SO2与O2能100%转化为SO3
C. 减小O2的浓度能加快反应速率
D. 使用恰当的催化剂能加快反应速率
4. 上述材料中的反应为放热反应,下列说法正确的是( )
A. 断开化学键放出能量
B. 放热反应都不需要加热
C. 该反应的逆反应是吸热反应
D. 该反应的反应物总能量小于生成物的总能量
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2
 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。1. SO2与O2在一定条件下反应生成SO3,该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是
A. O2是还原剂 B. SO2被氧化
C. O2失去电子 D. SO2发生还原反应
3. 上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是
A. 升高温度能减慢反应速率
B. SO2与O2能100%转化为SO3
C. 减小O2的浓度能加快反应速率
D. 使用恰当的催化剂能加快反应速率
4. 上述材料中的反应为放热反应,下列说法正确的是
A. 断开化学键放出能量
B. 放热反应都不需要加热
C. 该反应的逆反应是吸热反应
D. 该反应的反应物总能量小于生成物的总能量
您最近一年使用:0次
名校
解题方法
7 . 联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
1. 为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素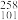 Md的质量数为
Md的质量数为( )
A. 101 B. 157 C. 258 D. 359
2. Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是( )
A. 质子数 B. 电子层数 C. 核外电子数 D. 最外层电子数
3. 判断Cl的非金属性比S的强,可依据的事实是( )
A. HCl的热稳定性比H2S的强 B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态 D. AgCl是白色固体,Ag2S是黑色固体
4. 锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是( )
A. 最高化合价为+2 B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈 D. 最高价氧化物对应的水化物碱性比钠的弱
1. 为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素
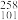 Md的质量数为
Md的质量数为A. 101 B. 157 C. 258 D. 359
2. Mg和Si都属于元素周期表第3周期元素,它们原子结构中相同的是
A. 质子数 B. 电子层数 C. 核外电子数 D. 最外层电子数
3. 判断Cl的非金属性比S的强,可依据的事实是
A. HCl的热稳定性比H2S的强 B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态 D. AgCl是白色固体,Ag2S是黑色固体
4. 锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是
A. 最高化合价为+2 B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈 D. 最高价氧化物对应的水化物碱性比钠的弱
您最近一年使用:0次
名校
解题方法
8 . 完成下列问题
(1)绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是_______ ;
②证明其已完全被氧化的试剂是 现象是_______ 。
(2)已知FeSO4·7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是_______ 。

(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)z•nH2O。工业上常用的一种制备流程为:

取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g。确定该固体聚合硫酸铁样品的化学式。(写计算过程)_______
(1)绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是
②证明其已完全被氧化的试剂是 现象是
(2)已知FeSO4·7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是

(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)z•nH2O。工业上常用的一种制备流程为:

取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g。确定该固体聚合硫酸铁样品的化学式。(写计算过程)
您最近一年使用:0次
2010高二·湖南·学业考试
9 . 在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

(1)画出D的原子结构示意图_______ ;
(2)写出C的最高价氧化物的电子式__________ ;
(3)E和F分别形成的气态氢化物中最稳定的是________ (填写氢化物的化学式)
(4)A最高价氧化物的水化物的化学式____________ 。

(1)画出D的原子结构示意图
(2)写出C的最高价氧化物的电子式
(3)E和F分别形成的气态氢化物中最稳定的是
(4)A最高价氧化物的水化物的化学式
您最近一年使用:0次
10 . 新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出 性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是 。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是 。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有 性。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出 性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是 。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是 。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有 性。
您最近一年使用:0次
2010-06-18更新
|
1449次组卷
|
7卷引用:2010—2011年度江苏省宿迁市沭阳县怀明中学学业水平考试化学模拟试卷
(已下线)2010—2011年度江苏省宿迁市沭阳县怀明中学学业水平考试化学模拟试卷(已下线)2010年湖南省普通高中学业水平考试化学卷2014-2015湖南省娄底市高二上学期期末考试化学(文)试卷湖北省仙桃市汉江高级中学2016-2017学年高一下学期期中考试化学试题湖南省邵阳市崀山培英学校2018-2019学年高二下学期期中考试化学试题(已下线)2010年湖南省普通高中学业水平考试化学试题湖南省长沙县第九中学2021-2022学年高一上学期期中考试化学试题



