名校
解题方法
1 . 乙醇俗称酒精,分子式为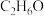 ,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应:
,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应: ;不完全燃烧时会有CO生成。请回答下列问题:
;不完全燃烧时会有CO生成。请回答下列问题:
(1)0.5mol 与
与_______ g  含有的氧原子数相同。
含有的氧原子数相同。
(2)同温同压下,同体积的 和CO的物质的量之比为
和CO的物质的量之比为_______ ,质量之比为_______
(3)乙醇完全燃烧时,每消耗9.6g ,生成
,生成 的体积为
的体积为_______ L(标准状况下)。
(4)将23g乙醇溶于一定量的水中配制成500mL乙醇溶液(密度为 ),则该溶液的物质的量浓度为
),则该溶液的物质的量浓度为_______ 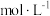 ,质量分数为
,质量分数为_______ %。
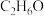 ,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应:
,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应: ;不完全燃烧时会有CO生成。请回答下列问题:
;不完全燃烧时会有CO生成。请回答下列问题:(1)0.5mol
 与
与 含有的氧原子数相同。
含有的氧原子数相同。(2)同温同压下,同体积的
 和CO的物质的量之比为
和CO的物质的量之比为(3)乙醇完全燃烧时,每消耗9.6g
 ,生成
,生成 的体积为
的体积为(4)将23g乙醇溶于一定量的水中配制成500mL乙醇溶液(密度为
 ),则该溶液的物质的量浓度为
),则该溶液的物质的量浓度为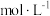 ,质量分数为
,质量分数为
您最近一年使用:0次
2022-11-17更新
|
180次组卷
|
2卷引用:贵州省部分学校2022-2023学年高一上学期期中联合考试化学试题
名校
解题方法
2 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:_________ 。
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:_________ 。
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是_________ 。倒出量筒内水的体积后,折算成标准状况下O2的体积为1120 mL,计算样品中Na2O2的质量分数约为_________ 。
(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。
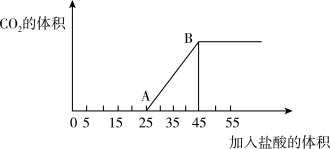
A点溶液中溶质为:_________ ,计算原NaOH溶液的物质的量浓度是_________ mol/L。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和
 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。

A点溶液中溶质为:
您最近一年使用:0次
名校
解题方法
3 . 用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___ mL的容量瓶。
(2)经计算需要___ mL浓盐酸,在量取时宜选用下列量筒中的___ (填字母)。
A.5 mL量筒 B.10 mL量筒
C.25 mL量筒 D.50 mL量筒
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入选定规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是___________ (填序号)。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,则配制的稀盐酸浓度___________ (填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度___________ (填“偏高”“偏低”或“无影响”)。
(1)配制稀盐酸时,应选用容量为
(2)经计算需要
A.5 mL量筒 B.10 mL量筒
C.25 mL量筒 D.50 mL量筒
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入选定规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,则配制的稀盐酸浓度
您最近一年使用:0次
2022-07-23更新
|
348次组卷
|
8卷引用:贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题
贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题贵州省贵阳市清镇养正学校2020-2021学年高一上学期期中考试化学试题(已下线)专题二 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第05讲 物质的量浓度及溶液配制 (练)-2023年高考化学一轮复习讲练测(新教材新高考)云南省马关县第一中学校2021-2022学年高一下学期开学考试化学试题河南省郑州市中牟县第一高级中学2022-2023学年高一上学期第三次月考化学试题高一必修第一册(苏教2019)专题2 第二单元 溶液组成的定量研究2黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题
4 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_______ (选填编号)。
a.高炉炼铁 b.腐蚀印刷电路板 c.高温煅烧石灰石 d.燃放烟花炮竹
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。
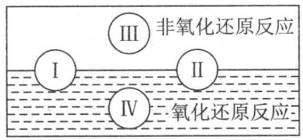
试写出有水参加且符合反应类型IV的一个化学方程式:_______ 。
(3)工业上利用 和
和 反应来制取单质
反应来制取单质 。
。
①配平下列化学方程式并标明电子转移的方向和数目:_______ 。
_____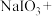 _____NaHSO3→_____
_____NaHSO3→_____
②该反应还原剂是____ ,____ 元素被还原,若生成1mol氧化产物则转移电子数目为___ NA。
(4)已知: 、
、 、
、 、
、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
_______ I-(填“ ”或“
”或“ ”),完成该反应
”),完成该反应_______ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.高炉炼铁 b.腐蚀印刷电路板 c.高温煅烧石灰石 d.燃放烟花炮竹
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。

试写出有水参加且符合反应类型IV的一个化学方程式:
(3)工业上利用
 和
和 反应来制取单质
反应来制取单质 。
。①配平下列化学方程式并标明电子转移的方向和数目:
_____
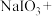 _____NaHSO3→_____
_____NaHSO3→_____
②该反应还原剂是
(4)已知:
 、
、 、
、 、
、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
 ”或“
”或“ ”),完成该反应
”),完成该反应
您最近一年使用:0次



