名校
解题方法
1 . 如图是部分短周期元素化合价与原子序数的关系图,下列说法错误的是
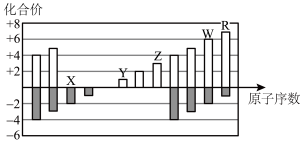

| A.由图可知并不是所有的元素的化合价都具有负价和正价 |
| B.原子半径最大的是Y |
| C.简单氢化物的稳定性:R>W |
| D.R的氧化物对应的水化物为强酸 |
您最近一年使用:0次
2024-03-09更新
|
227次组卷
|
2卷引用:广东省高州市某校2023-2024学年高一上学期期末模拟化学试题
名校
解题方法
2 . 化学与生活息息相关,下列说法不正确的
| A.添加小苏打蒸制“粵菜"糕点,小苏打的化学式为NaHCO3 |
| B.广府文化代表之一“镬耳屋”是使用青砖建造,青砖的青色来自Fe2O3 |
| C.不锈钢中常添加镍和铬元素,从而使其具有特殊性能 |
| D.铝制餐具不适宜长时间存放酸性或碱性食物 |
您最近一年使用:0次
2024-03-02更新
|
136次组卷
|
2卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题
名校
解题方法
3 . 化学与生产、生活密切相关,下列有关说法正确的是
| A.纯碱是用于治疗胃酸过多的一种药物 |
| B.工业上用氯气与冷的石灰乳反应可制得漂白粉 |
| C.食品包装袋中的小包铁粉用作干燥剂 |
| D.合金的特点是硬度比各成分金属小,熔点比各成分金属高 |
您最近一年使用:0次
2024-02-27更新
|
98次组卷
|
2卷引用:广东省高州市某校2023-2024学年高一上学期期末模拟化学试题
4 . 磺酰氯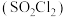 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量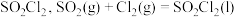 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为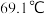 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4) 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量 )。
)。
(6)已知酸性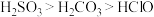 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为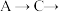
___________  ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
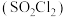 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量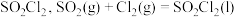 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为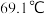 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.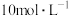 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为 )。
)。(6)已知酸性
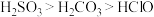 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为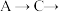
 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
156次组卷
|
2卷引用:广东省深圳实验学校高中部2023-2024学年高一上学期第三阶段考试化学试题
名校
解题方法
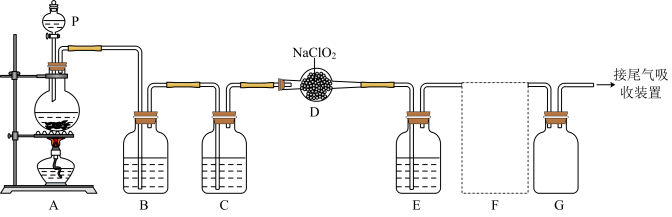
5 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2,成为自来水的消毒剂。已知ClO2是一种易溶于水的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2C1O2+2NaCl,下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品已省略),其中E用于除去ClO2中的未反应的Cl2。___________ 。
(2)写出装置A中烧瓶内发生反应的离子方程式:___________ 。
(3)B装置中所盛试剂是___________ 。
(4)F为ClO2收集装置,应选用的装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。
①请写出该反应的化学方程式:___________ ,每消耗319.5gNaClO3,生成___________ L氯气(标况下)。(M(NaClO3)=106.5)。
②浓盐酸在该反应中表现出来的性质是___________ (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)写出装置A中烧瓶内发生反应的离子方程式:
(3)B装置中所盛试剂是
(4)F为ClO2收集装置,应选用的装置是

①请写出该反应的化学方程式:
②浓盐酸在该反应中表现出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
您最近一年使用:0次
2024-02-02更新
|
145次组卷
|
3卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题
名校
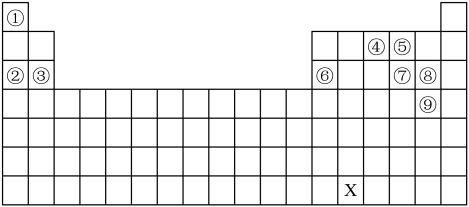
6 . 下列编号代表元素周期表中的一-部分元素,用化学用语回答下列问题:___________ ,它的最高价氧化物的电子式为___________ 。
(2)①④形成的化合物的化学键类型为___________ ,③⑧形成的化合物的电子式为___________ ,④形成的单质的结构式为___________ 。
(3)②⑥的最高价氧化物的水化物发生反应的离子方程式为___________ 。
(4)⑧⑨简单氢化物的稳定性较强的是___________ (写简单氢化物的化学式),⑤单质的氧化性比⑦的强,请从原子结构的角度解释其原因:___________ 。
(5)现拟用如下装置,证明元素的非金属性强弱:S>C,请选用合适的试剂完成实验。
(2)①④形成的化合物的化学键类型为
(3)②⑥的最高价氧化物的水化物发生反应的离子方程式为
(4)⑧⑨简单氢化物的稳定性较强的是
(5)现拟用如下装置,证明元素的非金属性强弱:S>C,请选用合适的试剂完成实验。

| 实验试剂 | 甲: |
| 可得出结论的实验现象 |
您最近一年使用:0次
2024-02-02更新
|
74次组卷
|
2卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题
名校
解题方法
7 . 随原子序数的递增,八种短周期元素的原子半径、最高正价或最低负价的变化如图所示。
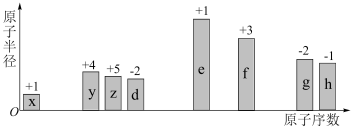
| A.离子半径的大小顺序:d<f<e |
| B.d与e组成的化合物一定只含离子键 |
| C.x、z、d组成的化合物一定是共价化合物 |
| D.h、g对应的阴离子还原性:h<g |
您最近一年使用:0次
2024-02-02更新
|
270次组卷
|
4卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题
名校
8 . 学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是______ ,胶体和溶液的本质区别是_______ 。
(2)生铁是______ (填“混合物”或“化合物”)。通常合金的熔点_____ (填“高于”或“低于”)其组成单质的熔点。
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得: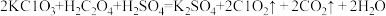 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为______ mol;该反应中的还原剂是______ (填化学式)。
(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=____ 。
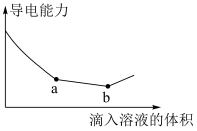
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是______ ,从a点到b点反应的离子方程式是______ ,解释b点之后导电能力上升的原因:______ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)生铁是
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:
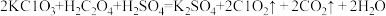 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是
您最近一年使用:0次
2024-01-28更新
|
109次组卷
|
4卷引用:广东省高州市某校2023-2024学年高一上学期期末模拟化学试题
22-23高一上·广东深圳·期末
名校
9 . 类推思维是化学学习中常用的一种方法,下列有关方程式的类推正确的是
A.Zn加入 溶液置换出Cu,Na加入 溶液置换出Cu,Na加入 溶液也置换出Cu 溶液也置换出Cu |
B.Fe与 点燃生成 点燃生成 ,则Fe与 ,则Fe与 点燃生成 点燃生成 |
C. 受热易分解, 受热易分解, 受热也易分解 受热也易分解 |
D. 通入 通入 产生白色沉淀, 产生白色沉淀, 通入 通入 也产生白色沉淀 也产生白色沉淀 |
您最近一年使用:0次
2024-01-25更新
|
111次组卷
|
7卷引用:广东省深圳中学2022-2023学年高一上学期期末考试化学试题
(已下线)广东省深圳中学2022-2023学年高一上学期期末考试化学试题(已下线)专项05 常见物质的性质、用途与转化-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)四川省绵阳市绵阳中学2023-2024学年高一上学期期末模拟测试化学试题云南省宣威市第六中学2023-2024学年高一上学期12月月考化学试题吉林省长春外国语学校2023-2024学年高一下学期开学化学试题吉林省通化市梅河口市第五中学2023-2024学年高一下学期开学化学试题江西省丰城市第九中学2023-2024学年高一下学期开学考试化学试题
名校
10 . “84消毒液”被广泛应用于物体表面杀菌消毒,化学兴趣小组设计了如图的实验装置制氯气探究氯气的性质并制备少量84消毒液:
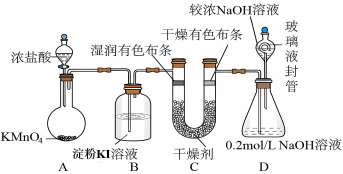
(1)盛放浓盐酸的仪器名称___________ ,酸性高锰酸钾作为强氧化剂其还原产物一般为Mn2+,装置A中反应的离子方程式是:___________ 。
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
(3)装置D中的玻璃液封管中NaOH溶液的作用是___________ 。
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是___________ 。
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
上述实验可以得到消毒液的漂白性强弱可能受___________ 影响。
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为: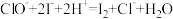 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到___________ 现象时,停止加入Na2S2O3。实验结束,测得共消耗20mLNa2S2O3,则计算消毒液中NaClO的浓度为___________ mol/L。

(1)盛放浓盐酸的仪器名称
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.无水CaCl2 |
(3)装置D中的玻璃液封管中NaOH溶液的作用是
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
| 实验组 | 试剂 | 现象 |
| ① | 10mL消毒液+1mL蒸馏水+红色纸条 | 2min后纸条红色褪去 |
| ② | 10mL消毒液+1mL稀硫酸+红色纸条 | 30s后纸条红色褪去 |
| ③ | 10mL消毒液+1mL稀NaOH+红色纸条 | 2min后纸条红色稍变浅 |
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为:
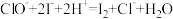 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
您最近一年使用:0次
2024-01-24更新
|
115次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题



