1 . 通过下列流程来制取少量亚硝酸钠(NaNO2),并进行纯度测定和性质实验:
已知:I.Na2CO3+NO+NO2=2NaNO2+CO2,Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___________ 。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___________ 。
(2)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00m L0.100mol•L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL 0.100mol•L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。
已知:NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2。
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___________ (“偏大”、“偏小”或“无影响”),原因是___________ 。
②通过计算,该样品中NaNO2的质量分数是___________ 。(写出计算过程)
(3)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体。该反应的离子方程式是___________ 。
已知:I.Na2CO3+NO+NO2=2NaNO2+CO2,Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是
(2)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00m L0.100mol•L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL 0.100mol•L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。
已知:NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2。
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度
②通过计算,该样品中NaNO2的质量分数是
(3)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体。该反应的离子方程式是
您最近半年使用:0次
2 . NH3易液化,可由Ca(OH)2与NH4Cl制得。制得的NH3能与CaCl2结合生成CaCl2·8NH3,加热条件下NH3能将CuO转化为Cu。工业上常用浓氨水检验输送氯气的管道是否泄露,Cl2能将NH3氧化为N2,同时产生NH4Cl。下列说法不正确的是
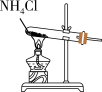
| A.实验室可用图所示的装置制取少量NH3 |
| B.制取的氨气可以用无水CaCl2进行干燥 |
| C.NH3将CuO转化为Cu时体现了NH3的还原性 |
| D.用氨水检验氯气泄露时发生的反应为8NH3+3Cl2=6NH4Cl+N2 |
您最近半年使用:0次
3 . 下列离子在溶液中可以大量共存的一组是
A.NH 、Na+、OH- 、Na+、OH- | B.K+、H+、CO | C.Na+、NO 、Cl- 、Cl- | D.Ba2+、SO 、NO 、NO |
您最近半年使用:0次
4 . 下列属于吸热反应的是
| A.石灰石分解 | B.甲烷燃烧 | C.钠与水反应 | D.酸碱中和 |
您最近半年使用:0次
解题方法
5 . 下列物质属于只含共价键的是
| A.NaCl | B.NH4Cl | C.N2 | D.KOH |
您最近半年使用:0次
6 . 下列离子方程式书写不正确的是
A.向 溴化亚铁溶液中通入标准状况下的 溴化亚铁溶液中通入标准状况下的 氯气: 氯气: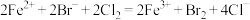 |
B.硫酸亚铁溶液与稀硫酸、双氧水混合: |
C.碳酸钙溶于硝酸: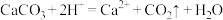 |
D.碳酸氢钠溶液与少量石灰水反应: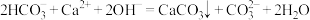 |
您最近半年使用:0次
7 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11g由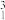 H和 H和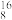 O组成的超重水中,含有的中子数目为5NA O组成的超重水中,含有的中子数目为5NA |
| B.标准状况下,22.4L三氧化硫的分子数约为NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA~0.2NA之间 |
您最近半年使用:0次
8 . 海水提溴
(1)主要流程
Cl2+2Br-=Br2+2Cl-(氧化)
Br2+SO2+2H2O=2HBr+H2SO4(富集)
Cl2+2Br-=_______ (提取)
(1)主要流程
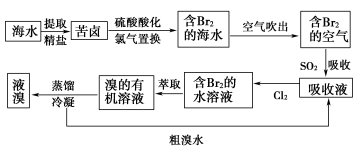
Cl2+2Br-=Br2+2Cl-(氧化)
Br2+SO2+2H2O=2HBr+H2SO4(富集)
Cl2+2Br-=
您最近半年使用:0次
22-23高一下·全国·单元测试
9 . 合理用药
(1)药物的分类:药物按来源分为_______ 与_______ 。
(2)药物的作用机理
①有的药物是通过改变机体细胞周围的物理、化学环境而发挥药效,如抗酸药。
②更多药物是通过药物分子与机体生物大分子的_______ 结合而发挥药效,其_______ 与生物活性密切相关。
(3)阿司匹林
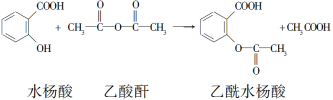
①阿司匹林化学名称为_______ ,具有_______ 作用。
②以水杨酸为原料制取阿司匹林的化学方程式为:_______ 会导致胃痛、头痛、眩晕、恶心等不适症状。
(4)合理用药
①在医生、_______ 指导下,遵循安全、有效、经济、适当等原则。
②滥用药物危害巨大。例如无处方长期服用_______ 或_______ ;滥用抗生素;运动员服用兴奋剂等。
③拒绝_______ 。
(1)药物的分类:药物按来源分为
(2)药物的作用机理
①有的药物是通过改变机体细胞周围的物理、化学环境而发挥药效,如抗酸药。
②更多药物是通过药物分子与机体生物大分子的
(3)阿司匹林
①阿司匹林化学名称为
②以水杨酸为原料制取阿司匹林的化学方程式为:
(4)合理用药
①在医生、
②滥用药物危害巨大。例如无处方长期服用
③拒绝
您最近半年使用:0次
名校
10 . 高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH 溶液,不溶于乙醇;具有强氧化性,在0℃~ 5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.湿法制备K2FeO4 (夹持装置略)_______ mL浓溶液,若所配制的稀溶液浓度偏大,则可能的原因是 _______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容
D.定容时,仰视液面
(2)A中发生反应的化学方程式是_______ 。
(3)下列试剂中,装置B的X溶液可以选用的是_______ (填字母)。
(4)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是_______ 。
Ⅱ.干法制备高铁酸钾分两步进行
(5)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化剂和还原剂的物质的量之比为_______ ,第二步反应为:Na2FeO4+2KCl=K2FeO4+2NaCl。
(6)实验室用100mL2.00mo/LFeSO4溶液发生上述反应,产品经干燥后得到纯品35.0g,则K2FeO4的产率为_______ (保留一位小数)。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH 溶液,不溶于乙醇;具有强氧化性,在0℃~ 5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.湿法制备K2FeO4 (夹持装置略)
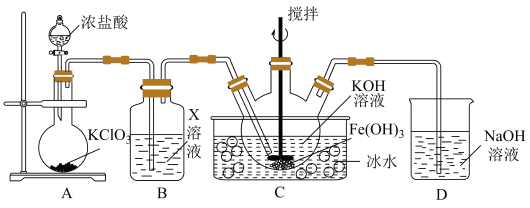
A.配制前,容量瓶中有少量蒸馏水
B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容
D.定容时,仰视液面
(2)A中发生反应的化学方程式是
(3)下列试剂中,装置B的X溶液可以选用的是_______ (填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(4)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是
Ⅱ.干法制备高铁酸钾分两步进行
(5)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化剂和还原剂的物质的量之比为
(6)实验室用100mL2.00mo/LFeSO4溶液发生上述反应,产品经干燥后得到纯品35.0g,则K2FeO4的产率为
您最近半年使用:0次



