名校
解题方法
1 . 接触法制硫酸、氨氧化法制硝酸、工业制备高纯硅经过下列主要变化:FeS2  SO2
SO2 SO3
SO3 H2SO4 NH3
H2SO4 NH3  NO
NO NO2
NO2  HNO3 SiO2
HNO3 SiO2 Si(粗)
Si(粗) SiHCl3
SiHCl3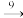 Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
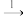 SO2
SO2 SO3
SO3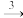 H2SO4 NH3
H2SO4 NH3  NO
NO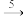 NO2
NO2  HNO3 SiO2
HNO3 SiO2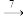 Si(粗)
Si(粗) SiHCl3
SiHCl3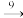 Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)| A.所有变化都是氧化还原反应 |
| B.2、4、5、8 都是化合反应, 反应3、6均用水作吸收剂 |
C.反应7的化学方程式为SiO2 +C  Si+CO2 Si+CO2 |
| D.反应1每生成标况下17.92 L SO2转移4.4mol电子;反应9每生成1molSi转移4mol电子 |
您最近一年使用:0次
2021-05-10更新
|
1295次组卷
|
3卷引用:湖北省武汉市武钢三中2022-2023学年高一下学期3月月考化学试题
2 . 甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如图(1)所示;在催化剂作用下,HCOOH分解生成CO2和H2的反应机理如图(2)所示。

下列叙述不正确的是

下列叙述不正确的是
| A.氢能属于二次能源 |
| B.图(1)循环示意图中,涉及的能量转化方式至少有3种 |
| C.光催化H2O分解生成1 mol H2与甲酸分解生成1 mol H2转移电子的物质的量相等 |
| D.按图(2)反应机理,用HCOOK溶液代替HCOOH催化产氢的效果更佳 |
您最近一年使用:0次
名校
3 . +5价V在不同pH下微粒的化学式不同,其微粒与pH关系如表所示。
另外,V价态不同在溶液中颜色不同,如V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO (黄色)、VO
(黄色)、VO (无色)、V5O
(无色)、V5O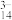 (红棕色)等。下列说法正确的是
(红棕色)等。下列说法正确的是
| 含钒元素的不同微粒 | VO | VO | V2O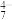 | VO |
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
 (黄色)、VO
(黄色)、VO (无色)、V5O
(无色)、V5O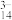 (红棕色)等。下列说法正确的是
(红棕色)等。下列说法正确的是A.VO 转化为V2O 转化为V2O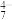 的离子反应为2VO 的离子反应为2VO +H2O=V2O +H2O=V2O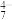 +2H+ +2H+ |
B.含VO 的溶液中滴加氨水有NH4VO3沉淀产生,该过程V元素被还原 的溶液中滴加氨水有NH4VO3沉淀产生,该过程V元素被还原 |
C.酸性VO 滴加烧碱溶液,溶液显红棕色时离子反应为5VO 滴加烧碱溶液,溶液显红棕色时离子反应为5VO +8OH-=V5O +8OH-=V5O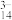 +4H2O +4H2O |
| D.紫色VSO4溶液中滴加酸性高锰酸钾溶液,溶液颜色出现绿色→蓝色→黄色,两个过程均失去1mol电子 |
您最近一年使用:0次
2021-04-14更新
|
969次组卷
|
12卷引用:湖北师大附中2021届高三下学期教学质量测评化学试题
湖北师大附中2021届高三下学期教学质量测评化学试题湖北省华大新高考联盟2021-2022学年高三下学期开学考试化学试题湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题(已下线)2021年高考化学押题预测卷(山东卷)02(含考试版、答题卡、参考答案、全解全析)第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题浙江省绍兴市2022届高三选考科目适应性考试(二模)化学试题陕西省西安市长安区第一中学2021-2022学年高一下学期期末考试化学(理科)试题陕西省西安市长安区第一中学2021-2022学年高一下学期期末考试化学(理科)试题黑龙江省富锦市第一中学2022-2023学年高二下学期期末考试化学试题河南省济源市第四中学2023-2024学年高一上学期11月月考化学试题河南省洛阳市宜阳县第一高级中学2023-2024学年高一下学期竞赛选拔赛化学试题河南省周口恒大中学2023-2024学年高三下学期4月期中考试化学试题
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂,工业上可先制得高铁酸钠(离子反应为2Ee(OH)3+3ClO-+4OH-=2 +3Cl-+5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
+3Cl-+5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
 +3Cl-+5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
+3Cl-+5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是| A.高铁酸钾能除去水中溶解的H2S等 |
| B.高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀毒 |
| C.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子 |
| D.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 |
您最近一年使用:0次
2021-04-01更新
|
164次组卷
|
11卷引用:湖北省孝感市汉川市第一高级中学2019-2020学年高二下学期摸底测试化学试题
湖北省孝感市汉川市第一高级中学2019-2020学年高二下学期摸底测试化学试题2017届黑龙江省哈尔滨六中高三上9月月考化学试卷2017届山东省德州一中高三上10月模块测试化学试卷河北省大名县第一中学2018届高三(普通班)上学期第一次月考化学试题黑龙江省大庆中学2018届高三上学期期中考试化学试题安徽省合肥市第九中学2019届高三第一次月考化学试题安徽省滁州市定远县民族中学2020届高三上学期期中考试化学试题安徽省定远县育才学校2021届高三8月月考化学试题新疆北屯高级中学2021届高三上学期10月月考化学试题江苏省苏州市第四中学2020-2021学年高一下学期3月月考化学试题北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题
名校
解题方法
5 . X、Y、Z、W是原子序数依次增大的4种短周期元素,其中Y和Z的单质是组成空气的主要成分,W的原子半径是短周期主族元素中最大的,X、Y、Z三种元素可组成一种化合物M,M的结构式为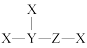 。下列说法正确的是
。下列说法正确的是
| A.M中各原子均达8电子稳定结构 |
| B.由Y、Z、W三种元素形成的化合物只有一种 |
| C.Y、Z、W形成的简单离子半径大小顺序为W>Y>Z |
| D.M可作还原剂,与Cl2反应生成1 mol Y2时失去2 mol e- |
您最近一年使用:0次
2021-03-07更新
|
2290次组卷
|
12卷引用:湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题
湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题湖北省应城市第一高级中学2022-2023学年高一下学期第一次阶段性检测化学试题重庆市强基联合体2021届高三下学期质量检测化学试题(已下线)重点6 物质结构与元素周期律-2021年高考化学【热点·重点·难点】专练(山东专用)河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)小题14 元素周期表、律(根据物质结构角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)江西省南昌市第十中学2020-2021学年高一下学期第二次月考化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题(已下线)仿真卷06-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)单项选择题1-5
6 . 过氧化氢俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl=2NaCl+H2O2 B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2 2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)_______ ,H2O2既体现氧化性又体现还原性的反应是_______ ,H2O2体现酸性的反应是_______ 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是_______ 。
(3)储存过氧化氢的试剂瓶上最适合贴上的一个标签是_______ (填序号)。

(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、 、H2O、 Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程: H2O2→O2。
、H2O、 Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程: H2O2→O2。
①反应体系选择的酸是_______ (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为_______ mol。
A.Na2O2+2HCl=2NaCl+H2O2 B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2
 2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O(1)上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(3)储存过氧化氢的试剂瓶上最适合贴上的一个标签是

(4)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、
 、H2O、 Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程: H2O2→O2。
、H2O、 Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程: H2O2→O2。①反应体系选择的酸是
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为
您最近一年使用:0次
2021-03-06更新
|
126次组卷
|
2卷引用:湖北省仙桃市沔城高级中学2021-2022学年高三上学期10月月考化学试题
7 . 为了防止枪支生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: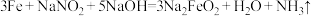 。下列有关的叙述不正确的是
。下列有关的叙述不正确的是
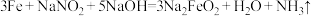 。下列有关的叙述不正确的是
。下列有关的叙述不正确的是A.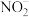 的氧化性大于 的氧化性大于 的氧化性 的氧化性 |
| B.反应中转移电子2mol,则生成还原产物0.5mol |
| C.枪支“发蓝”实质上是使铁表面钝化导致难以生锈 |
| D.上述反应中,单质铁被氧化,而NaNO2作为氧化剂 |
您最近一年使用:0次
2021-03-05更新
|
691次组卷
|
10卷引用:湖北省新高考协作体2021-2022学年高一上学期期中化学考试题
湖北省新高考协作体2021-2022学年高一上学期期中化学考试题湖北省2021-2022学年高一上学期期中考试化学试题湖南省长沙市雅礼中学2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】双师208高一下湖南省湘中部分学校2020-2021学年高一下学期期末考试化学试题陕西省咸阳市泾阳县2021-2022学年高三上学期期中考试化学试题湖南省衡阳市第八中学2022-2023学年高一上学期期末考试化学试题广东省汕头市实验学校2022-2023学年高一上学期期末质量检测化学试题 四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题四川省宜宾市叙州区第二中学校2022-2023学年高一上学期期中考试化学试题
名校
8 . 按要求回答下列问题:
(1)写出下列反应对应的离子方程式:
①CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4_______
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O_______
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中具有_______ 性。
(3)按要求填写相关量。
①2Na2O2+2H2O = 4NaOH+O2↑反应中,每生成1分子 O2转移_______ 个电子;
②2NaHCO3 = Na2CO3+H2O+CO2↑反应中,每消耗168 g NaHCO3,生成_______ g CO2。
(4)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):

写出下列物质的化学式:试剂C_______ ,沉淀2_______ ;
(1)写出下列反应对应的离子方程式:
①CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中具有
(3)按要求填写相关量。
①2Na2O2+2H2O = 4NaOH+O2↑反应中,每生成1分子 O2转移
②2NaHCO3 = Na2CO3+H2O+CO2↑反应中,每消耗168 g NaHCO3,生成
(4)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):

写出下列物质的化学式:试剂C
您最近一年使用:0次
解题方法
9 . 某教授课题组报道了以分级多孔结构的In2S3作为光辅助Li—CO2电池的正极的研究,转化中发生反应 ,下列有关该反应的说法正确的是
,下列有关该反应的说法正确的是
 ,下列有关该反应的说法正确的是
,下列有关该反应的说法正确的是| A.属于氧化还原反应,反应中铟(In)元素被氧化 |
| B.反应中CO2是氧化剂,碳元素化合价升高 |
| C.每消耗4.4g的CO2,反应中转移的电子的物质的量为0.2mol |
| D.In+只有还原性,In3+只有氧化性 |
您最近一年使用:0次
10 . 无水FeCl2是重要化工产品,常用于制备补血制剂和催化剂。资料显示:①FeCl2遇水蒸气易潮解;②实验室用NaCl固体和浓硫酸混合共热制备HCl;在加热条件下HCl和铁粉反应制备无水FeCl2。某小组拟制备无水FeCl2并探究其性质:

回答下列问题:
(1)E中倒置的干燥管的作用是______ 。
(2)实验设计要求“简约化”,可选用下列装置替代D和E的是______ (填字母)。

(3)A装置中生成一种正盐,写出化学方程式:______ 。
(4)测定FeCl2产品的纯度:取w gFeCl2产品配制成250 mL溶液,取25.00 mL配制的溶液于锥形瓶中,加入V mLc mol/LAgNO3溶液恰好完全反应。
①本实验配制溶液时需要定容仪器的名称是______ 。
②该产品纯度为______ (用含w、c 和V代数式表示)。
(5)在H2O2和HI的混合溶液中加入FeCl2溶液,H2O2+2HI=2H2O+I2的反应过程分两步进行:①H2O2+2H++2Fe2+=2Fe3++2H2O;②2Fe3++2I-=I2+2Fe2+。下列有关推断正确的是______ (填字母)。
a.Fe2+作总反应的反应物 b.在反应①中 Fe2+作还原剂
c.Fe2+作总反应的催化剂 d.1 mol H2O2完全反应转移1 mol电子

回答下列问题:
(1)E中倒置的干燥管的作用是
(2)实验设计要求“简约化”,可选用下列装置替代D和E的是

(3)A装置中生成一种正盐,写出化学方程式:
(4)测定FeCl2产品的纯度:取w gFeCl2产品配制成250 mL溶液,取25.00 mL配制的溶液于锥形瓶中,加入V mLc mol/LAgNO3溶液恰好完全反应。
①本实验配制溶液时需要定容仪器的名称是
②该产品纯度为
(5)在H2O2和HI的混合溶液中加入FeCl2溶液,H2O2+2HI=2H2O+I2的反应过程分两步进行:①H2O2+2H++2Fe2+=2Fe3++2H2O;②2Fe3++2I-=I2+2Fe2+。下列有关推断正确的是
a.Fe2+作总反应的反应物 b.在反应①中 Fe2+作还原剂
c.Fe2+作总反应的催化剂 d.1 mol H2O2完全反应转移1 mol电子
您最近一年使用:0次



