名校
解题方法
1 . 氧化亚铜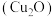 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。
已知: (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇;
 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。___________ 和 。
。
(2)写出浸取时发生反应的离子方程式___________ 。
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式___________ ,每生成 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为___________ 。
(4)洗涤过程中,用无水乙醇洗涤的目的是___________ 。
(5)证明得到的 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是___________ 。
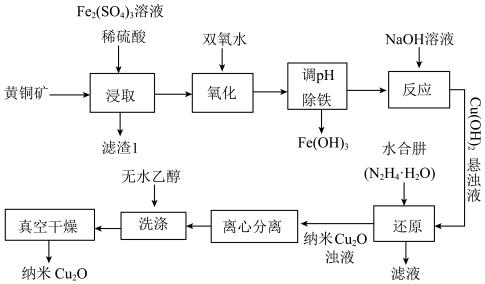
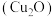 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。已知:
 (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇; 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。
 。
。(2)写出浸取时发生反应的离子方程式
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式
 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为(4)洗涤过程中,用无水乙醇洗涤的目的是
(5)证明得到的
 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是
您最近半年使用:0次
名校
2 . 科学家最近用金属钠、CCl4、SiCl4制得SiC纳米棒,该反应的化学方程式为:8Na+CCl4+SiCl4=SiC+8NaCl。下列说法错误的是
| A.SiC和SiO2中Si元素的化合价相同 |
| B.生成1molSiC,转移8mol电子 |
| C.SiC硬度很大,可作砂纸和砂轮的磨料 |
| D.上述反应中SiC既是氧化产物又是还原产物 |
您最近半年使用:0次
3 . 纳米球状红磷可提高钠离子电池的性能,可由PCl5(易水解)和NaN3制备: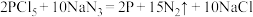 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
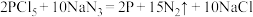 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.11.2 L N2含π键数目为 |
B.每生成3.1 g P转移电子数目为 |
C.0.1 mol NaN3晶体中含离子数目为 |
D.0.1 mol PCl5与足量水反应,所得溶液中 的数目为 的数目为 |
您最近半年使用:0次
名校
解题方法
4 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.2g氘化锂(6LiD)中含中子数为NA |
| B.100g质量分数为46%的乙醇(C2H5OH)溶液中含有氧原子数为NA |
C.120g由NaHSO4和MgSO4组成的混合固体中 数目为NA 数目为NA |
| D.过氧化钠与水的反应生成1molO2时,转移的电子数为NA |
您最近半年使用:0次
解题方法
5 . 现有一种以“沸石笼”为载体对NO进行催化还原的原理如图所示,下列说法正确的是


| A.反应过程中O原子的成键数目保持不变 |
B. 作催化剂,虚线内物质是中间体 作催化剂,虚线内物质是中间体 |
| C.反应④涉及非极性键的断裂和生成 |
| D.反应⑤中转移3mol电子时,有1molNO参与反应 |
您最近半年使用:0次
2024-04-02更新
|
225次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
6 . 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为 .下列有关该反应的说法错误的是
.下列有关该反应的说法错误的是
 .下列有关该反应的说法错误的是
.下列有关该反应的说法错误的是| A.属于氧化还原反应 | B.只有木炭是还原剂 |
C. 中的氮元素被还原 中的氮元素被还原 | D.生成 ,转移 ,转移 电子 电子 |
您最近半年使用:0次
7 . CO2可以支持镁燃烧,反应为2Mg+CO2 2MgO+C。下列关于该反应的判断不正确的是
2MgO+C。下列关于该反应的判断不正确的是
 2MgO+C。下列关于该反应的判断不正确的是
2MgO+C。下列关于该反应的判断不正确的是| A.该反应属于置换反应 | B.CO2发生氧化反应 |
| C.被氧化的物质是Mg | D.1个CO2参加反应,转移电子数为4e- |
您最近半年使用:0次
8 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
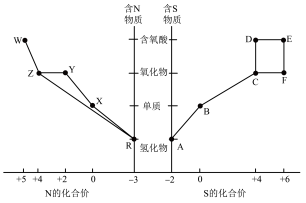
回答下列问题:
(1)写出物质R的电子式___________ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是___________ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是___________ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 中所含化学键类型为
中所含化学键类型为___________ , 水溶液显
水溶液显___________ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: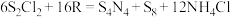 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有___________ ,该反应每生成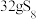 转移电子
转移电子___________ mol。

回答下列问题:
(1)写出物质R的电子式
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 中所含化学键类型为
中所含化学键类型为 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: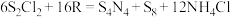 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有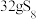 转移电子
转移电子
您最近半年使用:0次
解题方法
9 . 氧化还原反应是一类非常重要的反应.回答下列问题:
(1)按如图所示操作,充分反应后.

①Ⅰ中发生反应的离子方程式为:____________________________________ 。
②Ⅱ中溶液中观察到的现象是:____________________________________ 。
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为:____________________ 。
(2)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应: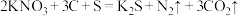 ,其中氧化产物是
,其中氧化产物是_______ .
(3)人体内的铁元素以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(4)市场上出售的某种麦片中含有微量铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成Fe2+。用单线桥法标出该化学方程式反应电子转移数目为_____________ 。
(5)写出氢气还原氧化铜的化学方程式,用双线桥法表示电子转移的方向数目:___________________________ .
(6)在 的反应中,每有1个Fe参加反应,被还原的HNO3为
的反应中,每有1个Fe参加反应,被还原的HNO3为_______ 个。
(1)按如图所示操作,充分反应后.

①Ⅰ中发生反应的离子方程式为:
②Ⅱ中溶液中观察到的现象是:
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为:
(2)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应:
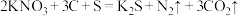 ,其中氧化产物是
,其中氧化产物是(3)人体内的铁元素以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有
(4)市场上出售的某种麦片中含有微量铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成Fe2+。用单线桥法标出该化学方程式反应电子转移数目为
(5)写出氢气还原氧化铜的化学方程式,用双线桥法表示电子转移的方向数目:
(6)在
 的反应中,每有1个Fe参加反应,被还原的HNO3为
的反应中,每有1个Fe参加反应,被还原的HNO3为
您最近半年使用:0次
10 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。
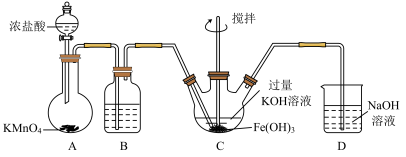
资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价_____ 。
(2)装置B中的试剂为_____ ,作用_____ 。
(3)装置C中制备K2FeO4时,发生反应的化学方程式为_____ ,每得到1mol K2FeO4,理论上消耗Cl2的物质的量为_____ mol。
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为_____ ,高铁酸钾作为水处理剂起到的作用是_____ 。
(5)制备 K2FeO4可以采用干式氧化法,初始反应为
 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为_____ 。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价
(2)装置B中的试剂为
(3)装置C中制备K2FeO4时,发生反应的化学方程式为
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为
(5)制备 K2FeO4可以采用干式氧化法,初始反应为

 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为
您最近半年使用:0次



