名校
解题方法
1 . 从宏观现象探究微观本质是重要的化学学科素养。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
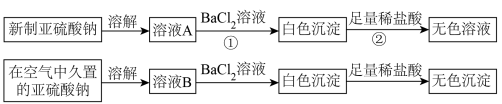
(1)写出上述实验中②的离子方程式:_________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有________ (填化学式)。
(3)亚硫酸钠晶体样品若变质,下列说法错误的是___________ 。
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
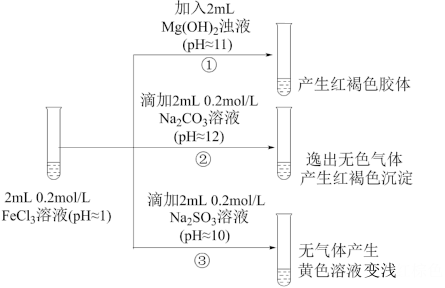
(1)①中反应的离子方程式是___________ 。
(2)②中逸出的无色气体是_____________ (写化学式)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是______________ 。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:

(1)写出上述实验中②的离子方程式:
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
(3)亚硫酸钠晶体样品若变质,下列说法错误的是
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
您最近一年使用:0次
2 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2593次组卷
|
11卷引用:北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷
北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题(已下线)热点19 化学微型实验
名校
解题方法
3 . 已知还原性: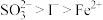 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:
通过实验得出的结论正确的是
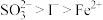 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:| 实验编号 | 操作 | 现象 |
| ① | 取 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| ② | 向实验①的水溶液中加入足量 和 和 溶液 溶液 | 可得到白色沉淀 |
| ③ | 取 原溶液,加入过量的 原溶液,加入过量的 溶液并加热 溶液并加热 | 产生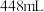 气体(标准状况) 气体(标准状况) |
A.实验①中若通入过量的 ,则可能先后氧化了 ,则可能先后氧化了 、 、 |
B.上述3个实验不能确定是否一定含有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 |
| C.判断溶液中是否含有钾离子,需要通过焰色反应来检验 |
D.实验②能够确定溶液中不含有 |
您最近一年使用:0次
2021-09-10更新
|
485次组卷
|
4卷引用:山西省运城市2022届高三上学期入学摸底测试化学试题
山西省运城市2022届高三上学期入学摸底测试化学试题(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)天津市滨海新区塘沽第一中学2022届高三第一次月考化学试卷江西省新余市第一中学2021-2022学年高三上学期第二次模拟考试化学试题
解题方法
4 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 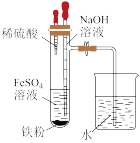 | 实验室制取Fe(OH)2 |
| B |  | 验证Na2SO3溶液是否变质 |
| C |  | 比较Na2CO3和 NaHCO3的热稳定性 |
| D | 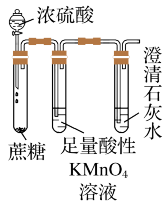 | 验证浓硫酸的脱水性、强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
11-12高三上·广西桂林·阶段练习
名校
解题方法
5 . 某学生做如下实验:第一步,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝:第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液、蓝色逐渐消失,并检测到有硫酸钠生成。下列叙述中该同学对实验原理的解释和所得结论不正确 的是
A.氧化性:HClO>I2>SO |
| B.若将足量Na2SO3溶液加入氯水中,氯水褪色 |
| C.蓝色消失的原因是Na2SO3溶液具有漂白性 |
| D.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝 |
您最近一年使用:0次
2021-04-12更新
|
552次组卷
|
26卷引用:浙江省之江教育评价2020-2021学年高一下学期返校联考化学试题
浙江省之江教育评价2020-2021学年高一下学期返校联考化学试题(已下线)2012届广西桂林十八中高三上学期第三次月考化学试卷(已下线)2011-2012学年山东省济宁汶上一中高一下学期3月月考化学试卷(已下线)2013届山东省德州市跃华学校高三12月月考化学试卷(已下线)2012-2013学年江西省南昌市第二中学高一下学期期中考试化学试卷2015届山东省枣庄二中高三元月模拟测试化学试卷2015-2016学年河北省正定中学高一上学期期末化学试卷黑龙江省哈尔滨市122中学2017-2018学年高一上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题贵州省遵义育新高级中学2018-2019学年高一上学期11月考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷(已下线)【新东方】2020--98安徽省怀宁县新安中学2019-2020学年高二下学期期末考试化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP404】【化学】(已下线)【浙江新东方】89.福建省莆田第一中学2020-2021学年高一上学期期末考试化学试题广东省梅州市(梅州、蕉中、虎中)三校2020-2021学年高一下学期4月联考化学试题(已下线)【浙江新东方】在线化学61高一下广东省广州越秀三校2021-2022学年高一下学期期中联考化学试题福建省莆田第四中学2021-2022学年高一上学期期末考试化学试题河南省郑州市第七高级中学2022-2023 学年高一上学期期末考试化学试题广西钦州市2022-2023学年高一上学期第2次教学质量监测化学试卷广东省汕头市实验学校2022-2023 学年高—下学期第一阶段质量检测化学试题山东省枣庄市第三中学2023-2024学年高一上学期1月期末模拟化学试题
名校
解题方法
6 . 为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是_______ 。②样品中Na2CO3的质量分数为_______ 。
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
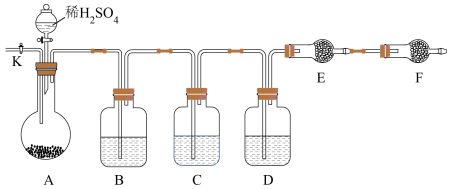
①已知仪器C中装有品红溶液,其作用是_______ ,
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中_______ ,D中_______ ,E中_______ 。
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是_______ 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是_______ 。
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

①已知仪器C中装有品红溶液,其作用是
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是
您最近一年使用:0次
2023-08-22更新
|
75次组卷
|
2卷引用:江西省吉安市万安中学2023-2024学年高二上学期开学考试化学试题
7 . 实验室以浓硫酸、铜与NaOH溶液为原料制取少量NaHSO3并探究其性质,已知CuCl为白色难溶于水的化合物。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是____ 。
(2)装置丙的作用是____ 。
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:____ 。
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设1不合理,实验证据是____ 。
②实验证实假设2合理,实验II中发生反应的离子方程式有____ 和H++HSO =SO2↑+H2O。
=SO2↑+H2O。
III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。
(5)请解释出现该实验现象可能的原因:____ 。
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)
(6)滴定终点的颜色变化为____ ,NaHSO3固体的纯度为____ (用含V和w的代数式表示)。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是
(2)装置丙的作用是
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验II中发生反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO
 +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。(5)请解释出现该实验现象可能的原因:
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO
 +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)(6)滴定终点的颜色变化为
您最近一年使用:0次
名校
解题方法
8 . 根据信息写方程式:
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体。试写出Pb3O4与浓盐酸反应的化学方程式:__________________________________ 。
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定度的I2溶液进行滴定,滴定反应的离子方程式为________________________________ 。
(3)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:________________________________________ 。
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体。试写出Pb3O4与浓盐酸反应的化学方程式:
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定度的I2溶液进行滴定,滴定反应的离子方程式为
(3)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:
您最近一年使用:0次



