1 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
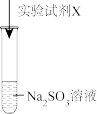 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
2 . 某小组通过实验探究NO的某些性质。
(1)从氮元素的价态角度分析,NO有_____ 性。
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为______ 。
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O 。
。
ⅱ.Ag+与N2O 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验SO 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,_____ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,_____ (填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是_____ 。
③写出NO与碱性Na2SO3溶液反应的离子方程式______ 。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
氧化反应:_____ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:_____ 。
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是_____ 。
②再向生成的溶液中加入一定量_____ ,以此溶液来吸收NO气体。
(1)从氮元素的价态角度分析,NO有
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
 。
。ⅱ.Ag+与N2O
 反应生成黄色沉淀。
反应生成黄色沉淀。①检验SO
 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,
上述实验证明NO有氧化性。
实验Ⅱ的目的是
③写出NO与碱性Na2SO3溶液反应的离子方程式
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O

氧化反应:
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是
②再向生成的溶液中加入一定量
您最近一年使用:0次
2022-01-17更新
|
411次组卷
|
3卷引用:北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题
北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
名校
解题方法
3 . 某同学从物质类别、元素价态的角度,预测 和
和 部分化学性质。
部分化学性质。
(1)从物质类别角度, 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为___________ 。
(2)从硫元素的价态角度分析, 既有氧化性又有还原性,
既有氧化性又有还原性,___________ 。
①将 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是___________ 。
A. B.S C.
B.S C. D.
D.
② 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为___________ 。
(3)查阅资料后发现, 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是___________ 。但在实验过程中,他并没有检测到该气体生成,可能的原因是___________ 。
 和
和 部分化学性质。
部分化学性质。(1)从物质类别角度,
 属于酸性氧化物,预测
属于酸性氧化物,预测 可以和强碱反应,将少量
可以和强碱反应,将少量 通入NaOH溶液中,反应的离子方程式为
通入NaOH溶液中,反应的离子方程式为(2)从硫元素的价态角度分析,
 既有氧化性又有还原性,
既有氧化性又有还原性,①将
 通入酸性
通入酸性 溶液中,溶液紫色褪去,生成
溶液中,溶液紫色褪去,生成 。反应结束后,硫元素存在形式应该是
。反应结束后,硫元素存在形式应该是A.
 B.S C.
B.S C. D.
D.
②
 还能和
还能和 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为(3)查阅资料后发现,
 的部分化学性质与
的部分化学性质与 类似。该同学向
类似。该同学向 溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
溶液中加入稀硝酸,预测能产生一种刺激性气味的气体,该气体是
您最近一年使用:0次
解题方法
4 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类。我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:① ;②
;②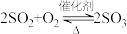 ;③
;③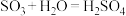 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
 ;②
;②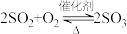 ;③
;③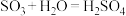 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是
、质量分数为98%的浓硫酸。下列有关硫及其化合物的性质与用途具有对应关系的是| A.二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂 |
| B.亚硫酸钠溶液显碱性,可用于吸收少量的二氧化硫 |
| C.硫具有还原性,可用硫黄处理洒落的汞单质 |
| D.硫酸铜溶液具有酸性,可用作泳池杀菌剂 |
您最近一年使用:0次
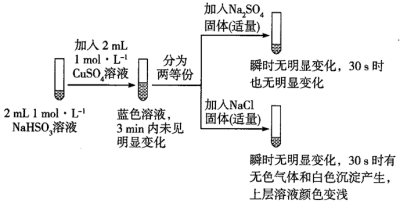
5 . 某同学为探究NaHSO3溶液与Cu2+的反应,查阅资料设计如下实验:
已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。
[Cu(NH3)4]2+(深蓝色溶液)。
回答下列问题:
(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色,则该气体是___________ (填化学式);工业上将Na2S和Na2CO3以2:1的物质的量比配成溶液,然后通入该无色气体,Na2S、Na2CO3完全反应,得到硫代硫酸钠(Na2S2O3)和另一种无色无味的气体,该过程中发生反应的化学方程式是___________ 。
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
①假设1不成立的原因是___________ 。
②若假设2合理,请将假设2补充完整:___________ ,其中生成的白色沉淀是___________ (填化学式)。
(3)通过分析实验可知,Cl-增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:___________ (写两点即可)。
(4)将实验后的溶液静置24小时或加热后,得到红色沉淀,洗涤干燥后利用已知信息设计实验,证明红色沉淀中含有Cu+:___________ 。

已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。
[Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色,则该气体是
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
| 假设1 | Cu2+水解使溶液中c(H+)增大 |
| 假设2 | Cl-存在时, 将Cu2+还原为Cu+,___________ 将Cu2+还原为Cu+,___________ |
②若假设2合理,请将假设2补充完整:
(3)通过分析实验可知,Cl-增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:
| 编号 | 实验1 | 实验2 |
| 实验 | 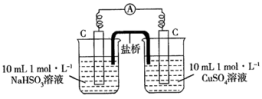 |  |
| 现象 | 电流表指针发生微小偏转 | 电流表指针发生明显偏转,_________ |
您最近一年使用:0次
2021-02-08更新
|
499次组卷
|
2卷引用:武汉市第一中学2021-2022学年高三上学期10月月考化学试题
名校
解题方法
6 . 某小组同学对 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。
(1)测得 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因___________ 。
(2)调节 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:
资料:ⅰ. :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。
ⅱ. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
针对实验 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:
推测1:白色沉淀为 。
。
推测2:白色沉淀为 。
。
①推测1产生该沉淀的反应用离子方程式表示___________ 。
②推测2的理论依据是___________ 。
③取 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)为确认 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;
Ⅲ.用 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①Ⅰ的目的是___________ 。
②根据Ⅲ的现象,可判断 的元素组成
的元素组成___________ 。
③Ⅱ中反应的化学方程式是___________ 。
(4)综合以上实验,分析 产生的可能原因:
产生的可能原因:
①甲同学认为随着溶液酸性增强, 中的
中的 氧化性增强。
氧化性增强。
②乙同学认为___________ 。
 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。(1)测得
 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因(2)调节
 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:| 实验 |  | 现象 |
 | 10 | 产生白色沉淀,稍后沉淀溶解 |
 | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
 | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
 :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。ⅱ.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。针对实验
 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:推测1:白色沉淀为
 。
。推测2:白色沉淀为
 。
。①推测1产生该沉淀的反应用离子方程式表示
②推测2的理论依据是
③取
 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于(3)为确认
 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;Ⅲ.用
 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①Ⅰ的目的是
②根据Ⅲ的现象,可判断
 的元素组成
的元素组成③Ⅱ中反应的化学方程式是
(4)综合以上实验,分析
 产生的可能原因:
产生的可能原因:①甲同学认为随着溶液酸性增强,
 中的
中的 氧化性增强。
氧化性增强。②乙同学认为
您最近一年使用:0次
2021-10-19更新
|
688次组卷
|
2卷引用:北京市北京中国人民大学附属中学2022届高三10月检测化学试卷
名校
解题方法
7 . 资料显示Fe2+呈淡绿色、Fe3+呈棕黄色、FeSO3是墨绿色沉淀Fe(OH)3胶体是红褐色液体。某高三老师在讲授“Fe3+的氧化性”时,组织学生进行探究实验。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:___________ 。
(2)甲同学认可猜想一,他预测的实验现象是_____ ,其反应的离子方程式为____ 。
老师安排甲同学做了如下实验i:
(3)乙同学观察实验现象后认为猜想二合理,并想用红色激光笔照射该红褐色液体以验证自己的猜想正确,他预测的现象是_____ 。实验发现,乙同学的猜想成立,反应的离子方程式为_____ 。
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有
你认为方案②______ (填“合理”或“不合理”),你的理由是______ 。
甲同学在老师的指导下迅速完成了实验ii:
乙同学也在老师的指导下完成了方案①的操作,发现有蓝色沉淀生成。
通过实验探究,大家认识到Fe3+与 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
(1)在课堂教学探究Na2SO3溶液与FeCl3溶液的实际反应时,同学们有以下猜想,请补充完整:
猜想一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生双水解反应,产生了Fe(OH)3胶体;
猜想三:
(2)甲同学认可猜想一,他预测的实验现象是
老师安排甲同学做了如下实验i:
| 装置 | 操作 | 现象 |
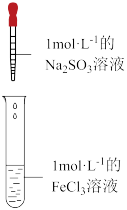 | 向2mL1mol•L-1的FeCl3溶液中,逐滴滴加2mL1mol•L-1的Na2SO3溶液 | 溶液黄色逐渐加深,最终得到红褐色液体(W) |
(4)针对“氧化还原反应有没有发生”,老师组织同学们讨论,同学们思考得出以下检验方案:
方案①:取少量W液体,加铁氰化钾溶液,检验是否有Fe2+
方案②:取少量W液体,加酸性高锰酸钾溶液,检验是否有Fe2+
方案③:取少量W液体,加盐酸酸化,再加氯化钡溶液,检验是否有

你认为方案②
甲同学在老师的指导下迅速完成了实验ii:
| 装置 | 操作 | 现象 |
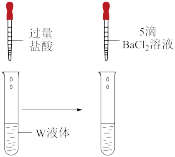 | 取1mLW液体于试管中,滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
通过实验探究,大家认识到Fe3+与
 的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
的反应体系中,氧化还原反应与水解反应不仅共存还存在竞争。
您最近一年使用:0次
2020-12-01更新
|
323次组卷
|
2卷引用:河南省南阳市第一中学校2021届高三上期第五次考试化学试题
名校
解题方法
8 . 硫及其主要的化合物在化学研究及生产生活中都有重要的应用。
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如 、
、 )可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(1)利用 处理污水中的铜离子,该反应过程的离子方程式为
处理污水中的铜离子,该反应过程的离子方程式为_______ ;
(2)从硫元素化合价的角度, 具有什么性质
具有什么性质_______ 。某同学预测硫化钠溶液可以与氯气发生氧化还原反应。他将不同浓度的硫化钠溶液分别注入两支盛有氯气的采集管中,振荡混合反应,发现其中一支试管中产生淡黄色沉淀物。据此写出发生反应的化学方程式_______ 得出的结论是 的还原性
的还原性_______  (填“强于”或“弱于”)。另一支试管中无明显现象,同学推测生成物可能为亚硫酸钠或硫酸钠。
(填“强于”或“弱于”)。另一支试管中无明显现象,同学推测生成物可能为亚硫酸钠或硫酸钠。
(3)在 和
和 可能存在的体系中,如何检验
可能存在的体系中,如何检验 ?请用文字将检验过程描述完整
?请用文字将检验过程描述完整_______ 。
II.探究二:认识亚硫酸钠
(4)从元素化合价角度思考, 应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的离子方程式
应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的离子方程式_______ 。
(5)同学们还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却无明显现象,你能推测原因或提出解决办法吗?_______ 。
(6)取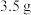 长期存放的
长期存放的 粉末(部分
粉末(部分 被氧化为
被氧化为 ),加入过量的
),加入过量的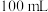 某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为
某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为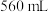 。求
。求 的纯度
的纯度_______ 。
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如
 、
、 )可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)(1)利用
 处理污水中的铜离子,该反应过程的离子方程式为
处理污水中的铜离子,该反应过程的离子方程式为(2)从硫元素化合价的角度,
 具有什么性质
具有什么性质 的还原性
的还原性 (填“强于”或“弱于”)。另一支试管中无明显现象,同学推测生成物可能为亚硫酸钠或硫酸钠。
(填“强于”或“弱于”)。另一支试管中无明显现象,同学推测生成物可能为亚硫酸钠或硫酸钠。(3)在
 和
和 可能存在的体系中,如何检验
可能存在的体系中,如何检验 ?请用文字将检验过程描述完整
?请用文字将检验过程描述完整II.探究二:认识亚硫酸钠
(4)从元素化合价角度思考,
 应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的离子方程式
应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的离子方程式(5)同学们还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却无明显现象,你能推测原因或提出解决办法吗?
(6)取
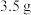 长期存放的
长期存放的 粉末(部分
粉末(部分 被氧化为
被氧化为 ),加入过量的
),加入过量的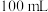 某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为
某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为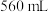 。求
。求 的纯度
的纯度
您最近一年使用:0次
名校
9 . 硫及其主要的化合物在化学研究及生产生活中都有重要的应用。
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(1)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为_______
(2)从硫元素化合价的角度,Na2S具有什么性质_______ 。小荟同学预测硫化钠溶液可以与氯气发生氧化还原反应。他将不同浓度的硫化钠溶液分别注入两支盛有氯气的采集管中,振荡混合反应,发现其中一支试管中产生淡黄色沉淀物。据此写出发生反应的化学方程式_______ 得出的结论是Cl-的还原性_______ S2-(填“强于”或“弱于”)。另一支试管中无明显现象,小荟推测生成物可能为亚硫酸钠或硫酸钠。
(3)在Na2SO4和Na2SO3可能存在的体系中,如何检验 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,_______
II.探究二:认识亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(4)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的现象为_______
(5)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?_______
(6)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求Na2SO3的纯度_______ ;
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(1)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为
(2)从硫元素化合价的角度,Na2S具有什么性质
(3)在Na2SO4和Na2SO3可能存在的体系中,如何检验
 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,II.探究二:认识亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(4)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的现象为
(5)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?
(6)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求Na2SO3的纯度
您最近一年使用:0次
10 . 某学生对 与
与 不同的
不同的 下反应进行探究。
下反应进行探究。
(1)调节pH,实验记录如下:
查阅资料得知:
i. :白色,难溶于水,溶于过量
:白色,难溶于水,溶于过量 溶液;
溶液;
ii. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
①推测a中白色沉淀为 ,离子方程式是
,离子方程式是___________ 。
②推测a中白色沉淀为 ,推测的依据是
,推测的依据是___________ 。
(2)取 中白色沉淀,置于过量
中白色沉淀,置于过量 溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是
溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是 ,实验方法是:另取
,实验方法是:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)将c中 滤出、洗净,为确认其组成,实验如下:
滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 产生红棕色气体;
产生红棕色气体;
Ⅲ.用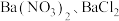 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①实验I的目的是___________
②根据上述现象,分析X的性质和元素组成是___________
③Ⅱ中反应的化学方程式是___________ 。
(4)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强。通过进一步实验确认了这种可能性,实验如下:
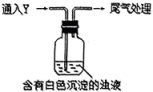
①气体Y是___________ 。
②白色沉淀转化为X的化学方程式是___________ 。
 与
与 不同的
不同的 下反应进行探究。
下反应进行探究。(1)调节pH,实验记录如下:
| 实验 |  | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
i.
 :白色,难溶于水,溶于过量
:白色,难溶于水,溶于过量 溶液;
溶液;ii.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。①推测a中白色沉淀为
 ,离子方程式是
,离子方程式是②推测a中白色沉淀为
 ,推测的依据是
,推测的依据是(2)取
 中白色沉淀,置于过量
中白色沉淀,置于过量 溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是
溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是 ,实验方法是:另取
,实验方法是:另取 固体置于
固体置于(3)将c中
 滤出、洗净,为确认其组成,实验如下:
滤出、洗净,为确认其组成,实验如下:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 产生红棕色气体;
产生红棕色气体;Ⅲ.用
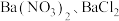 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①实验I的目的是
②根据上述现象,分析X的性质和元素组成是
③Ⅱ中反应的化学方程式是
(4)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强。通过进一步实验确认了这种可能性,实验如下:

①气体Y是
②白色沉淀转化为X的化学方程式是
您最近一年使用:0次



