1 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
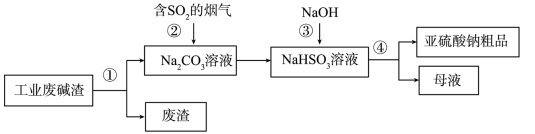
(1)为加快工业废碱渣中 的溶解,可采取的措施是
的溶解,可采取的措施是___________ (写出一种即可)。
(2)过程①进行的操作是___________ ,若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要___________ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为___________ 。
(4)亚硫酸钠粗品中含有少量 ,原因是
,原因是___________ (用化学方程式表示)。
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,___________ ,出现白色沉淀,则证明含有 。
。
(6) 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:___________ 。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
(1)为加快工业废碱渣中
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)过程①进行的操作是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量
 ,原因是
,原因是(5)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(6)
 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:
您最近一年使用:0次
2023-05-29更新
|
103次组卷
|
3卷引用:山东省郓城第一中学2023-2024学年高二上学期开学考试化学试题
名校
2 . 下列物质的性质与用途具有对应关系的是
| A.SiO2硬度大,可用于制作光导纤维 |
| B.K2FeO4具有强氧化性,可用于杀菌消毒 |
| C.NaHCO3受热易分解,可用于治疗胃酸 |
| D.Na2SO3溶液呈碱性,可用于污水脱氯(Cl2) |
您最近一年使用:0次
解题方法
3 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
2021-01-27更新
|
457次组卷
|
3卷引用:广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题
广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练
名校
4 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向Na2O2溶液中滴加酚酞试剂,先变红后褪色,证明Na2O2具有漂白性 |
您最近一年使用:0次
2023-01-14更新
|
254次组卷
|
2卷引用:山东省曹县第一中学 2022-2023学年高一下学期开学考试化学试题
名校
解题方法
5 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
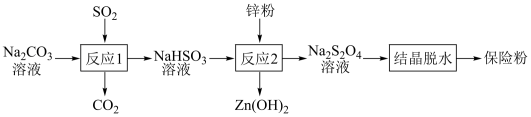
下列说法错误的是

下列说法错误的是
| A.反应1说明酸性:H2SO3>H2CO3 |
| B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 |
| C.反应2最好在无氧条件下进行 |
| D.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化 |
您最近一年使用:0次
2021-11-04更新
|
803次组卷
|
5卷引用:陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题
陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题江西省奉新县第一中学2021-2022学年上学期高三第一次月考化学试题(已下线)3.2.2 硫酸 不同价态硫元素间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省安康市2022-2023学年高二上学期11月期中化学试题
解题方法
6 . 硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,氧化产物为___________ (填化学式)。
②将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2.该反应的化学方程式为___________ 。
(2)铬会造成环境污染。某酸性废水中含有Cr2O ,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O
,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O 转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为___________ 。
②处理后的废水中Cr3+的物质的量浓度为___________ mol·L-1。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1∶2时,氧化产物为
②将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2.该反应的化学方程式为
(2)铬会造成环境污染。某酸性废水中含有Cr2O
 ,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O
,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O 转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。
转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52 mg·L-1,达到排放标准。①Na2S2O5参加反应的离子方程式为
②处理后的废水中Cr3+的物质的量浓度为
您最近一年使用:0次
7 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO溶液中存在HClO分子 |
| D.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
您最近一年使用:0次
8 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应 |
您最近一年使用:0次
2021-06-29更新
|
9599次组卷
|
21卷引用:山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题
山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题2021年新高考山东化学高考真题山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2021-2022学年高三下学期4月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)河北省唐山市第一中学2022-2023学年高三上学期11月期中考试化学试题
解题方法
9 . 易混易错题组:离子方程式的书写
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为______________ 。
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式__________________ 。
(学法题)书写此类离子方程式的关键是,抓住______________ 量物质。
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为___________________ 。
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:____________ 。
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的__________ 顺序。
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为_________________ 。
②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为___________________________ 。
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________ 。
④对比②和③实验所得的结果,将I2、ClO-、 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为___________ 。
(1)量变引起离子方程式的变化
将少量NaHSO4溶液滴加到Ba(OH)2溶液中,当恰好沉淀时,反应的离子方程式为
向Ca(HCO3)2溶液中滴加过量NaOH溶液,反应的离子方程式
(学法题)书写此类离子方程式的关键是,抓住
(2)反应顺序引起的变化
向NH4HCO3溶液中,滴加过量的NaOH溶液,反应的离子方程式为
在FeI2溶液中,滴加少量稀硝酸。该反应的离子方程式是:
(学法题)书写此类离子方程式的关键是,抓住反应物中离子的
(3)反应介质的影响
①在酸性条件下,向含铬废水中加入FeSO4,可将
 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为②在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
③在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是
④对比②和③实验所得的结果,将I2、ClO-、
 按氧化性由强到弱的顺序排列为
按氧化性由强到弱的顺序排列为
您最近一年使用:0次
解题方法
10 . 下列物质的性质与用途具有对应关系的是
| A.NaHCO3受热易分解,可用于缓解胃酸过多 |
| B.Na2SO3具有还原性,可用作脱氧剂 |
| C.NaOH具有强碱性,可用作干燥剂 |
| D.Na2O2为淡黄色固体,可用作供氧剂 |
您最近一年使用:0次



