1 . 下列实验现象及结论都正确的是
A.向FeCl2溶液中滴加适量酸性高锰酸钾溶液,溶液变为棕黄色,说明MnO 可氧化Fe2+ 可氧化Fe2+ |
| B.蔗糖中滴入浓硫酸,开始时变黑色,说明浓硫酸有脱水性和强氧化性 |
| C.向Na2SO3溶液中加入盐酸酸化的硝酸钡溶液,生成白色沉淀,说明Na2SO3氧化变质 |
| D.向石蕊试液通入足量SO2气体,溶液先变红后褪色,说明SO2具有漂白性 |
您最近一年使用:0次
2 . 由下列实验操作和现象所得结论均正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液有白色沉淀产生 | 样品已变质 |
| B | 将盐酸滴入某溶液,产生能使澄清石灰水变浑浊的气体 | 溶液中有 |
| C | 铁投入冷的浓硝酸中无明显现象,投入稀硝酸中有气泡冒出 | 氧化性:稀硝酸>浓硝酸 |
| D | 向Na2SO3溶液中滴入稀盐酸,产生刺激性气味的气体可使品红溶液褪色 | 酸性:HCl>H2SO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-09更新
|
211次组卷
|
3卷引用:重庆市两江中学校2021-2022学年高一下学期第一次月考化学试题
名校
3 . 下列由实验现象所得结论错误的是
A.向 溶液中滴加氢硫酸,产生淡黄色沉淀,证明 溶液中滴加氢硫酸,产生淡黄色沉淀,证明 具有氧化性 具有氧化性 |
B.向浓 中插入红热的炭,产生红棕色气体,证明炭可与浓 中插入红热的炭,产生红棕色气体,证明炭可与浓 反应生成 反应生成 |
C.向酸性 溶液中加入 溶液中加入 粉末,紫色褪去,证明 粉末,紫色褪去,证明 中含 中含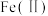 |
D.向 溶液中滴加酚酞试剂,先变红后褪色,证明 溶液中滴加酚酞试剂,先变红后褪色,证明 在溶液中发生了水解反应 在溶液中发生了水解反应 |
您最近一年使用:0次
4 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应 |
您最近一年使用:0次
2021-06-29更新
|
9757次组卷
|
21卷引用:内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题
内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题天津市第一中学2021-2022学年高三下学期4月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题2021年新高考山东化学高考真题山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年山东高考化学试题变式题1-10(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)河北省唐山市第一中学2022-2023学年高三上学期11月期中考试化学试题
解题方法
5 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
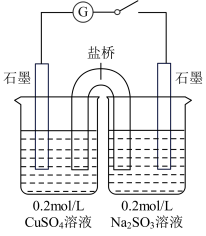
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
10-11高三上·四川成都·阶段练习
解题方法
6 . (Ⅰ)近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为_______ ,被氧化的元素为________ 。
(3)H2SO4在上述反应中表现出来的性质是___ (填字母)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为__________ 。
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
_______________________________________________________
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是____ 。
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是____ 。

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是
您最近一年使用:0次
名校
解题方法
7 . 化学是一门以实验为基础的学科,某同学为探究 溶液的性质进行如下实验,操作如图所示。查阅资料可知:
溶液的性质进行如下实验,操作如图所示。查阅资料可知:
① 可将
可将 氧化为S,
氧化为S, 也可以把
也可以把 氧化为
氧化为
②电解质可使胶体发生聚沉
③亚铁离子和硫离子在溶液中可生成 为黑色沉淀,该沉淀能溶于盐酸。
为黑色沉淀,该沉淀能溶于盐酸。
 溶液的性质进行如下实验,操作如图所示。查阅资料可知:
溶液的性质进行如下实验,操作如图所示。查阅资料可知:①
 可将
可将 氧化为S,
氧化为S, 也可以把
也可以把 氧化为
氧化为
②电解质可使胶体发生聚沉
③亚铁离子和硫离子在溶液中可生成
 为黑色沉淀,该沉淀能溶于盐酸。
为黑色沉淀,该沉淀能溶于盐酸。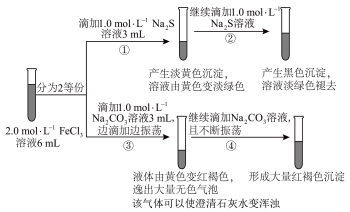
| A.向②后试管加入足量稀盐酸,沉淀全部溶解 |
| B.根据反应现象分析,①~④的变化中,只有1处涉及氧化还原反应 |
C.若将 溶液滴加到 溶液滴加到 溶液中,产生的现象与图中①、②现象相同 溶液中,产生的现象与图中①、②现象相同 |
D.若将 溶液更换成 溶液更换成 溶液,可产生相同的现象 溶液,可产生相同的现象 |
您最近一年使用:0次
2023-11-25更新
|
240次组卷
|
2卷引用:北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题
名校
8 . 化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
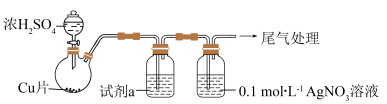
尾气吸收所用试剂是_______ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:_______ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是_______ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4.做出判断的理由:_______ 。
②实验三的结论:_______ 。
(4)实验一中,SO2与AgNO3溶液反应的离子方程式是_______ 。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

尾气吸收所用试剂是
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是
(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4.做出判断的理由:
②实验三的结论:
(4)实验一中,SO2与AgNO3溶液反应的离子方程式是
您最近一年使用:0次
9 . 工业上用辉铜矿(主要成分是Cu2S,还含有少量SiO2)制备CuCl的工艺流程如下:
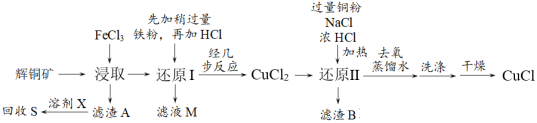
查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图_______ 。
(2)滤渣A的成分是_______ 。
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
(4)写出浸取时发生反应的离子方程式_______ 。
(5)检验滤液M是否氧化变质,应加入的最佳试剂为_______ 。
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为_______ 。
(7)洗涤时选择的最佳试剂是_______。
(8)CuSO4与Na2SO3溶液、NaCl溶液混合加热,也可以得到CuCl沉淀,写出反应的离子方程式_______ 。

查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图
(2)滤渣A的成分是
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
| A.水 | B.酒精 | C.CS2 | D.稀H2SO4 |
(5)检验滤液M是否氧化变质,应加入的最佳试剂为
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为
(7)洗涤时选择的最佳试剂是_______。
| A.稀盐酸 | B.酒精 | C.稀HNO3 | D.稀H2SO4 |
您最近一年使用:0次
名校
解题方法
10 . 实验题。查阅资料知:Br2的沸点为58.8℃,密度为3.119g·cm-3微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________ 态,保存时通常在盛溴的试剂瓶中加入少量__________ 。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
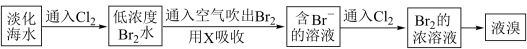
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴
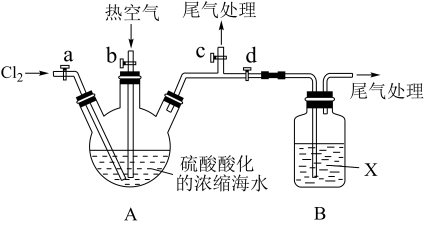
实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现_________ (实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是_________ (填序号),尾气处理选用_________ (填序号)。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________ 。
(4)蒸馏时应该选择_________ ,操作中应控制的关键实验条件为__________________ 。
Ⅰ.(1)常温下,单质溴通常呈
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
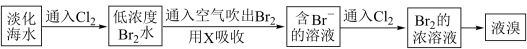
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴

实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现
(3)X试剂可以是
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为
(4)蒸馏时应该选择

您最近一年使用:0次
2017-02-17更新
|
275次组卷
|
3卷引用:2017届西藏林芝一中高三上月考四化学试卷



