1 . 某学生对 与
与 不同的
不同的 下反应进行探究。
下反应进行探究。
(1)调节pH,实验记录如下:
查阅资料得知:
i. :白色,难溶于水,溶于过量
:白色,难溶于水,溶于过量 溶液;
溶液;
ii. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
①推测a中白色沉淀为 ,离子方程式是
,离子方程式是___________ 。
②推测a中白色沉淀为 ,推测的依据是
,推测的依据是___________ 。
(2)取 中白色沉淀,置于过量
中白色沉淀,置于过量 溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是
溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是 ,实验方法是:另取
,实验方法是:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)将c中 滤出、洗净,为确认其组成,实验如下:
滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 产生红棕色气体;
产生红棕色气体;
Ⅲ.用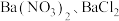 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①实验I的目的是___________
②根据上述现象,分析X的性质和元素组成是___________
③Ⅱ中反应的化学方程式是___________ 。
(4)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强。通过进一步实验确认了这种可能性,实验如下:___________ 。
②白色沉淀转化为X的化学方程式是___________ 。
 与
与 不同的
不同的 下反应进行探究。
下反应进行探究。(1)调节pH,实验记录如下:
| 实验 |  | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
i.
 :白色,难溶于水,溶于过量
:白色,难溶于水,溶于过量 溶液;
溶液;ii.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。①推测a中白色沉淀为
 ,离子方程式是
,离子方程式是②推测a中白色沉淀为
 ,推测的依据是
,推测的依据是(2)取
 中白色沉淀,置于过量
中白色沉淀,置于过量 溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是
溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是 ,实验方法是:另取
,实验方法是:另取 固体置于
固体置于(3)将c中
 滤出、洗净,为确认其组成,实验如下:
滤出、洗净,为确认其组成,实验如下:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 产生红棕色气体;
产生红棕色气体;Ⅲ.用
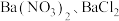 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①实验I的目的是
②根据上述现象,分析X的性质和元素组成是
③Ⅱ中反应的化学方程式是
(4)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强。通过进一步实验确认了这种可能性,实验如下:
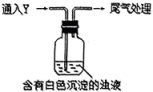
②白色沉淀转化为X的化学方程式是
您最近一年使用:0次
2024-03-09更新
|
118次组卷
|
2卷引用:中国人民大学附属中学2023-2024学年高三下学期化学练习6
名校
2 . 按要求回答下列问题
Ⅰ.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:_______ ,Y为_______ 。(均填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为_______ 。小登觉得可以设计实验验证这一推论,具体操作是_______ 。
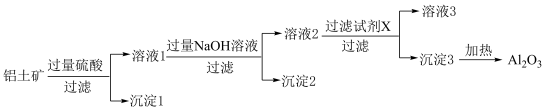
Ⅱ.铝土矿的主要成分是 Al2O3和少量 Fe2O3、SiO2,是工业制备铝单质的原料。模拟铝土矿制备 Al2O3的工艺流程如下图所示。
(3)溶液 1 中的金属阳离子除Al3+外还包括_______ 。
(4)溶液 1 中加入过量NaOH 溶液的目的是_______ 。
(5)沉淀1的主要成分是_______ ,该成分可以和氢氟酸反应,请写出反应方程式_______ 。
(6)沉淀3转化为Al2O3的化学方程式为_______ 。
(7)将 1000 kg 含铝 13.5 %(质量分数)的铝土矿经过上述流程进行加工,最多可以生产_______ kg Al2O3固体。
Ⅰ.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
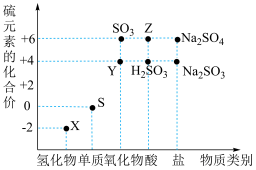
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为
Ⅱ.铝土矿的主要成分是 Al2O3和少量 Fe2O3、SiO2,是工业制备铝单质的原料。模拟铝土矿制备 Al2O3的工艺流程如下图所示。
(3)溶液 1 中的金属阳离子除Al3+外还包括
(4)溶液 1 中加入过量NaOH 溶液的目的是
(5)沉淀1的主要成分是
(6)沉淀3转化为Al2O3的化学方程式为
(7)将 1000 kg 含铝 13.5 %(质量分数)的铝土矿经过上述流程进行加工,最多可以生产
您最近一年使用:0次
2024-05-03更新
|
184次组卷
|
2卷引用:云南省大理白族自治州民族中学2023-2024学年高一下学期4月月考化学试题
3 . 碘酸钾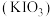 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。
I.制备
制备 实验装置如图:
实验装置如图:
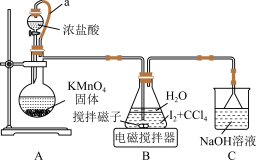
查阅资料: 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。
(1)装置 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是___________ 。
(2)装置 中制取
中制取 的化学反应方程式为
的化学反应方程式为___________ 。
II.制备
(3)从B中分离出 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和___________ 。加入 溶液中和制得
溶液中和制得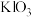 溶液,再加入适量
溶液,再加入适量___________ ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得 晶体。
晶体。
III.实验探究
为探究 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(4)溶液变蓝,表明 体现了
体现了___________ 性。
(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。
ii.猜想b:T秒前生成了 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为___________ (用离子方程式表示)。
(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的___________ (填化学式)溶液,蓝色迅速消失,后再次变蓝。
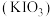 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。I.制备

制备
 实验装置如图:
实验装置如图:
查阅资料:
 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。(1)装置
 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是(2)装置
 中制取
中制取 的化学反应方程式为
的化学反应方程式为II.制备

(3)从B中分离出
 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和 溶液中和制得
溶液中和制得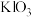 溶液,再加入适量
溶液,再加入适量 晶体。
晶体。III.实验探究
为探究
 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。(4)溶液变蓝,表明
 体现了
体现了(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想
 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。ii.猜想b:T秒前生成了
 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的
您最近一年使用:0次
名校
4 . 下表是某城市某日空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是____________________ 。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成________ 色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_____________ ,写出反应的化学方程式________________ 。
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)________ 。
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作________________ 。
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式_____________ 。
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | Ⅱ | 良 |
实验一:用下图所示装置进行实验。

(1)A装置的作用是
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成
(3)D装置的作用是
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式
您最近一年使用:0次
5 . “价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是

| A.a可用硫化亚铁与稀硝酸反应制取 |
B.可发生反应: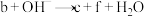 (未配平) (未配平) |
| C.c能使溴水褪色,证明c有漂白性 |
| D.f既有氧化性又有还原性 |
您最近一年使用:0次
2024-02-14更新
|
649次组卷
|
8卷引用:河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题
河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题河南省新乡市原阳县实验高级中学2023-2024学年高一下学期3月月考化学试题重庆市璧山来凤中学校2023-2024学年高一下学期3月月考化学试题江苏省南宁市第三十三中学2023-2024学年高一下学期3月月考化学试题河北省承德市2023-2024学年高一上学期期末考试化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
名校
6 . 下列关于物质的性质与用途的对应关系不正确的是
| A.Na2SO3具有还原性,可用于废水脱氯(Cl2) |
| B.FeCl3有强氧化性,可用于制作印刷线路板 |
| C.K-Na合金导热性好,可用作快中子反应堆热交换剂 |
| D.BaCO3难溶于水,可用于检查肠胃的内服药剂 |
您最近一年使用:0次
名校
解题方法
7 . 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,S8环状分子的结构为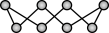 。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是
。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是
 。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是
。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关硫及其化合物的性质与用途具有对应关系的是| A.硫单质呈黄色,可用作橡胶硫化剂 |
| B.SO2具有氧化性,可用于漂白草编织物 |
| C.Na2SO3具有还原性,可用于处理自来水中残留的Cl2 |
| D.浓硫酸具有强氧化性,可用作酯化反应的催化剂 |
您最近一年使用:0次
2023-03-23更新
|
694次组卷
|
4卷引用:江苏省连云港高级中学2022-2023学年高二下学期第二次学情检测化学试题
江苏省连云港高级中学2022-2023学年高二下学期第二次学情检测化学试题江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题(已下线)专题05 元素化合物性质(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题6-10)
名校
8 . 学科思想方法是学好化学的关键,下列有关学科思想方法的理解正确 的是
| A.根据元素的性质分析,氮元素非金属较强,所以N2的化学性质较活泼 |
| B.SO2和氯水都具有漂白性,当SO2与Cl2体积比1:1通入水中所得溶液漂白性增强 |
| C.通过类比方法可知铝与稀硫酸反应生成氢气,则铝与稀硝酸反应生成氢气 |
| D.从硫的化合价角度分析,Na2SO3既有氧化性又有还原性 |
您最近一年使用:0次
名校
解题方法
9 . 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂:
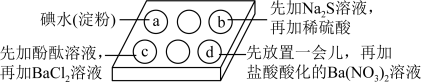
对实验现象的“解释或结论”错误的是

对实验现象的“解释或结论”错误的是
| 选项 | 实验现象 | 解释或结论 |
| A | a中溶液褪色 | 还原性: |
| B | b中加硫酸后产生淡黄色沉淀 |  和 和 在酸性条件下发生反应 在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | Na2SO3类似Na2CO3显碱性,所以滴入酚酞变红; 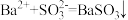 (白),Na2SO3反应完,红色褪去 (白),Na2SO3反应完,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是
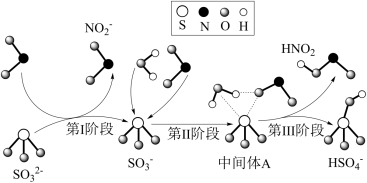

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近一年使用:0次
2022-11-20更新
|
1313次组卷
|
3卷引用:山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题
山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)



