解题方法
1 . 图1是自然界中硫元素的存在示意图,图2表示硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
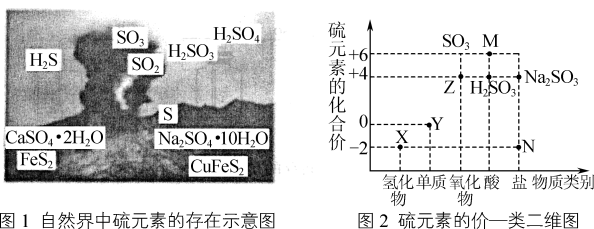
(1)图1中能与水反应生成强酸的物质的化学式为___________ 。
(2)煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是___________(填字母)。
(3)Cu和M的浓溶液反应生成Z的化学方程式为___________ 。
(4)Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是___________ 。

(1)图1中能与水反应生成强酸的物质的化学式为
(2)煤的燃烧会产生大量SO2造成环境污染,下列关于SO2治理措施不可行的是___________(填字母)。
| A.在燃煤中添加生石灰固硫 | B. SO2 |
| C.将煤燃烧产生的尾气排放到高空 | D.用氨水吸收烟气中的SO2 |
(4)Na2SO3溶液易变质,实验室验证Na2SO3溶液已变质的操作和现象是
您最近一年使用:0次
2 . 硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是___________ 。
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:___________ 。
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)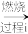 SeO2
SeO2 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒
①下列说法正确的是___________ (填字母序号)。
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(1)含+4价硫元素的化合物有SO2、H2SO3和X等。
①SO2能使品红溶液褪色,说明SO2具有的化学性质是
②已知X属于钠盐。写出X与稀硫酸反应生成SO2的化学方程式:
(2)以工业硒为原料制备高纯硒时的主要物质转化关系如图所示。
工业硒(Se)
 SeO2
SeO2 H2SeO3
H2SeO3 Se
Se 高纯硒
高纯硒①下列说法正确的是
A.硒原子的最外层有6个电子
B.硒元素的非金属性强于硫元素的非金属性
C.SeO2属于酸性氧化物
D.过程ⅰ中硒被氧化
②过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2.理论上,过程ⅰ消耗的O2与过程ⅲ消耗的N2H4·nH2O的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式表达不正确 的是
A.用氨水吸收废气中的氮氧化物:NO + NO2 + 2OH-=2NO + H2O + H2O |
B.用烧碱溶液除去铝片表面的氧化膜:Al2O3 + 2OH-=2AlO + H2O + H2O |
C.用亚硫酸钠溶液处理纸浆中残氯:SO + 2OH-+ Cl2=2Cl-+ SO + 2OH-+ Cl2=2Cl-+ SO + H2O + H2O |
D.用食醋消除松花蛋中的氨味:CH3COOH + NH3=CH3COO-+ NH |
您最近一年使用:0次
名校
解题方法
4 . Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s)  Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)
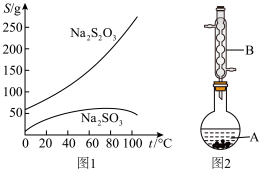
(1) 图2中,仪器B的名称是___________ 。
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是___________ 。
(3) 实验步骤③中,趁热过滤的原因是___________ 。
(4) 实验步骤④中,应采取的相关实验操作为___________ 。
(5) 实验步骤⑤中,采用低温干燥的目的是___________ 。
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________ 。
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是___________ 。消耗碘的标准溶液体积为36.00 mL,产品的纯度为___________ 。
 Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

(1) 图2中,仪器B的名称是
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是
(3) 实验步骤③中,趁热过滤的原因是
(4) 实验步骤④中,应采取的相关实验操作为
(5) 实验步骤⑤中,采用低温干燥的目的是
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O
 +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是
您最近一年使用:0次
2020-12-28更新
|
301次组卷
|
7卷引用:江苏省扬州市公道中学2020-2021学年下学期高二第二次学情测试化学试题



