1 . 下列实验不能达到预期目的是
①乙醇和30%的硫酸共热到170℃制乙烯
②用溴水除去混在苯中的乙烯,分液得到纯净的苯
③将溴乙烷加入NaOH溶液中共热,冷却后滴入AgNO3溶液,以此检验溴乙烷中的溴元素
④将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和Br2发生了加成反应
⑤将2%的NaOH溶液4~6滴,滴入2mL10%的CuSO4溶液中制得Cu(OH)2悬浊液,用作检验醛基的试剂
①乙醇和30%的硫酸共热到170℃制乙烯
②用溴水除去混在苯中的乙烯,分液得到纯净的苯
③将溴乙烷加入NaOH溶液中共热,冷却后滴入AgNO3溶液,以此检验溴乙烷中的溴元素
④将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和Br2发生了加成反应
⑤将2%的NaOH溶液4~6滴,滴入2mL10%的CuSO4溶液中制得Cu(OH)2悬浊液,用作检验醛基的试剂
| A.①②③④⑤ | B.②④ | C.①③⑤ | D.①②③⑤ |
您最近一年使用:0次
2023-06-30更新
|
152次组卷
|
2卷引用:河南省南阳市九校联盟2023-2024学年高二下学期质量检测化学试题
名校
2 . 下列实验装置能达到实验目的是(夹持仪器未画出)
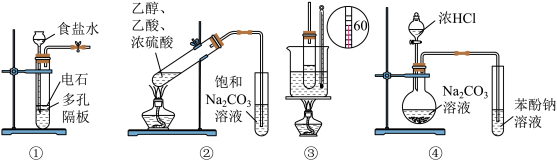
| A.①装置用于实验室制备乙炔 |
| B.②装置制备并收集乙酸乙酯 |
| C.③装置用于实验室制硝基苯 |
| D.④装置可装置证明酸性:盐酸>碳酸>苯酚 |
您最近一年使用:0次
2023-04-02更新
|
1483次组卷
|
11卷引用:河南省南阳市第一中学校2022-2023学年高二下学期(3月)第二次月考化学试题
河南省南阳市第一中学校2022-2023学年高二下学期(3月)第二次月考化学试题(已下线)烃——进阶学习广东省东莞中学、惠州市第一中学、深圳实验、中山纪念、珠海一中 2022-2023学年高二下学期“五校联考”化学试题山东省青岛第一中学2022-2023学年高二下学期期中考试化学试题山东省鄄城县第一中学2022-2023学年高二下学期5月月考化学试题广东省中山市2022-2023学年高二下学期期末统一考试化学试题四川省德阳市第五中学2022-2023学年高二下学期5月月考化学试题陕西省渭南市大荔县2022-2023学年高二下学期期末质量检测化学试题安徽省宿州市灵璧第一中学2022-2023学年高二下学期期末考试化学试题山东省菏泽市鄄城县第一中学2023-2024学年高二下学期4月月考化学试题新疆塔城地区第一高级中学2023-2024学年高二下学期5月期中考试化学试题
名校
3 . 下列有机物的检验方法正确的是
A.用热的NaOH水溶液和 溶液检验卤代烃中卤原子类别 溶液检验卤代烃中卤原子类别 |
B.向丙烯醛(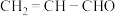 )中滴入酸性 )中滴入酸性 溶液,观察紫色褪去,能证明结构中存在碳碳双键 溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.用溴水溶液鉴别苯、溴乙烷、乙醇和NaI溶液四种液体 |
| D.用新制CaO检验乙醇中是否含有水分 |
您最近一年使用:0次
4 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
I.实验室制取氨气。
(1)图1装置中生成 的化学方程式为
的化学方程式为__________________________ 。检验圆底烧瓶中已收集满氨气的方法是____________________________________________________________ 。
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是______________________________ ;有同学认为需要在无水硫酸铜的后面再接一个装有 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是________________________________________ 。
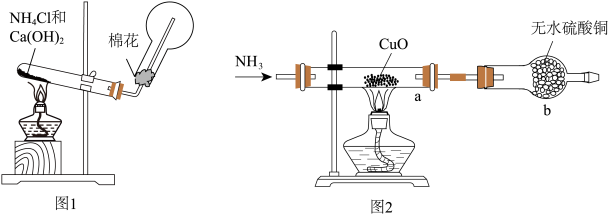
(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是__________ (填字母)。
(4)实验中观察到a中 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为________________________________________ ,证明氨气具有__________ (填“氧化”或“还原”)性;氨与氧气在高温、催化剂作用下的反应也体现了这一性质,该反应的化学方程式为______________________________ 。
(5)若向a中通入标准状况下 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为__________ g。

I.实验室制取氨气。
(1)图1装置中生成
 的化学方程式为
的化学方程式为II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是
 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是

(4)实验中观察到a中
 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为(5)若向a中通入标准状况下
 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为
您最近一年使用:0次
2023-02-18更新
|
1050次组卷
|
3卷引用:河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题
解题方法
5 . 为确定 、
、 、
、 的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是
的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是

 、
、 、
、 的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是
的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是
A.通过三者酸性的强弱比较,可以证明非金属性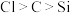 |
B.A中锥形瓶生成 气体 气体 |
C.B中装饱和 溶液,用于除去A中挥发出的 溶液,用于除去A中挥发出的 气体 气体 |
D.C中装 溶液,预期现象是先出现白色沉淀后又逐渐溶解 溶液,预期现象是先出现白色沉淀后又逐渐溶解 |
您最近一年使用:0次
2023-03-24更新
|
101次组卷
|
2卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
6 . 短周期主族元素W、X、Y、Z、M的原子序数依次增大,W的单质是空气的主要成分,X与Z的原子序数相差8,Y的原子半径是所有短周期主族元素中最大的,X与Y可形成化合物 。请回答下列问题:
。请回答下列问题:
(1)X、M的元素符号分别为_______ 、_______ 。W在元素周期表中的位置是_______ 。
(2)W、X简单氢化物的热稳定性由强到弱的顺序为_______ (用化学式表示);上述元素形成的含氧酸中酸性最强的为_______ (填化学式)。
(3)元素W与M能形成化合物Q,Q的结构式为_______ (用元素符号表示),其含有的化学键类型为_______ 。
(4)用电子式表示 的形成过程:
的形成过程:_______ 。
(5)化合物 与M的单质反应能证明Z、M的非金属性强弱,则该反应的化学方程式为
与M的单质反应能证明Z、M的非金属性强弱,则该反应的化学方程式为_______ 。
 。请回答下列问题:
。请回答下列问题:(1)X、M的元素符号分别为
(2)W、X简单氢化物的热稳定性由强到弱的顺序为
(3)元素W与M能形成化合物Q,Q的结构式为
(4)用电子式表示
 的形成过程:
的形成过程:(5)化合物
 与M的单质反应能证明Z、M的非金属性强弱,则该反应的化学方程式为
与M的单质反应能证明Z、M的非金属性强弱,则该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 醇与氢卤酸反应是制备卤代烃的重要方法。1-溴丙烷是一种重要的有机合成中间体,实验室制备少量1-溴丙烷的基本原理为
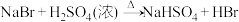 ;
;
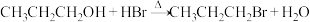 。
。
已知:醇在浓硫酸的存在下可能会发生脱水生成烯或醚,溶液中溴离子也可能被浓硫酸氧化为 ,已知溴单质溶解在1-溴丙烷中呈现棕黄色。
,已知溴单质溶解在1-溴丙烷中呈现棕黄色。
实验装置如下:

有关数据见下表:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入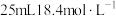 的浓
的浓 ;冷却至室温,搅拌下加入
;冷却至室温,搅拌下加入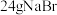 。
。
步骤2:按如图所示搭建实验装置,缓慢加热,直到无油状物蒸馏出为止。
回答下列问题:
(1)使用油浴加热的优点主要有___________ 。
(2)仪器A的容积最好选用___________。(填字母)
(3)步骤1中需20mL水进行稀释,目的是___________
a.减少副产物烯和醚的生成 b.水是反应的催化剂
c.增大1-溴丙烷的溶解度 d.减少 的生成
的生成
(4)在粗品分离提纯过程中:
①粗品往往呈现棕黄色,可选用___________ 除杂
A. 溶液 B.
溶液 B. C.
C. D.
D. 溶液
溶液
加入该试剂之后,接下来的操作中用到的主要玻璃仪器是___________
②如图所示,向分离后含有1-溴丙烷体系中加入无水硫酸镁,过滤,经过操作Ⅱ得到纯净的产品。
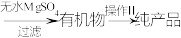
操作Ⅱ选择的装置为___________ 。

(5)本实验制得的纯产品为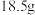 ,则产率为
,则产率为___________ (保留小数点后一位)。
(6)1-溴丙烷在不同溶剂中与 可发生不同类型的反应,生成不同的反应产物。某同学依据1-溴丙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
可发生不同类型的反应,生成不同的反应产物。某同学依据1-溴丙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

①在试管中加入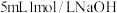 溶液和
溶液和 1-溴丙烷,将试管如图固定后,加热。试管口安装一长导管的作用是
1-溴丙烷,将试管如图固定后,加热。试管口安装一长导管的作用是___________ 。
②在消去反应实验中,为证明1-溴丙烷发生的是消去反应,在设计的实验方案中,如果用酸性高锰酸钾检验该有机产物,请画出简要的装置图___________ 。写出该消去反应方程式___________ 。
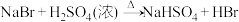 ;
;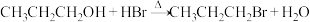 。
。已知:醇在浓硫酸的存在下可能会发生脱水生成烯或醚,溶液中溴离子也可能被浓硫酸氧化为
 ,已知溴单质溶解在1-溴丙烷中呈现棕黄色。
,已知溴单质溶解在1-溴丙烷中呈现棕黄色。实验装置如下:

有关数据见下表:
| 正丙醇 | 1-溴丙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/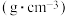 | 0.8 | 1.36 | 3.1 |
| 沸点/℃ | 97.2 | 71 | 59 |
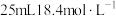 的浓
的浓 ;冷却至室温,搅拌下加入
;冷却至室温,搅拌下加入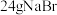 。
。步骤2:按如图所示搭建实验装置,缓慢加热,直到无油状物蒸馏出为止。
回答下列问题:
(1)使用油浴加热的优点主要有
(2)仪器A的容积最好选用___________。(填字母)
| A.50mL | B.100mL | C.250mL | D.500mL |
a.减少副产物烯和醚的生成 b.水是反应的催化剂
c.增大1-溴丙烷的溶解度 d.减少
 的生成
的生成(4)在粗品分离提纯过程中:
①粗品往往呈现棕黄色,可选用
A.
 溶液 B.
溶液 B. C.
C. D.
D. 溶液
溶液加入该试剂之后,接下来的操作中用到的主要玻璃仪器是
②如图所示,向分离后含有1-溴丙烷体系中加入无水硫酸镁,过滤,经过操作Ⅱ得到纯净的产品。
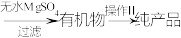
操作Ⅱ选择的装置为

(5)本实验制得的纯产品为
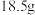 ,则产率为
,则产率为(6)1-溴丙烷在不同溶剂中与
 可发生不同类型的反应,生成不同的反应产物。某同学依据1-溴丙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
可发生不同类型的反应,生成不同的反应产物。某同学依据1-溴丙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
①在试管中加入
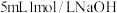 溶液和
溶液和 1-溴丙烷,将试管如图固定后,加热。试管口安装一长导管的作用是
1-溴丙烷,将试管如图固定后,加热。试管口安装一长导管的作用是②在消去反应实验中,为证明1-溴丙烷发生的是消去反应,在设计的实验方案中,如果用酸性高锰酸钾检验该有机产物,请画出简要的装置图
您最近一年使用:0次
解题方法
8 . Ⅰ.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的3倍,Y和Z可以形成两种以上气态化合物。则:
(1)X是__________ (填元素名称,下同),Y是__________ ,Z是__________ 。
(2)画出Z的离子结构示意图__________ 。
(3)由Y和Z组成,且Y和Z质量比为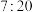 的化合物的化学式是
的化合物的化学式是__________ 。
(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为__________ ,四核10电子的分子的化学式是_______ 。
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为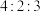 ,该盐的化学式是
,该盐的化学式是_____ 。
Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。
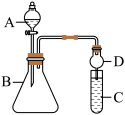
(6)仪器A的名称为__________ ,干燥管D的作用为__________ 。
(7)若要证明非金属性: ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为__________ ,观察到C中溶液__________ (填现象),即可证明非金属性: 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用__________ 吸收尾气。
(1)X是
(2)画出Z的离子结构示意图
(3)由Y和Z组成,且Y和Z质量比为
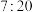 的化合物的化学式是
的化合物的化学式是(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为
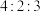 ,该盐的化学式是
,该盐的化学式是Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。

(6)仪器A的名称为
(7)若要证明非金属性:
 ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
您最近一年使用:0次
2023-03-24更新
|
105次组卷
|
2卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
9 . 某兴趣小组利用下图装置,制备少量的溴苯并探究其反应类型。

请回答下列问题:
(1)先向分液漏斗中加入苯和液溴,再将苯和液溴的混合液缓慢滴入反应器A中(A下端活塞处于关闭状态),则A中反应的化学方程式为_______ 。
(2)通过以下步骤可获取较纯净的溴苯:
①反应结束后打开A下端的活塞,让反应液流入B中;
②充分反应后,将B中液体转移至分液漏斗中,振荡、静置并分液;
③向有机层中加入蒸馏水洗涤,振荡、静置并分液;
④向有机层中加入无水 粉末干燥并过滤;
粉末干燥并过滤;
⑤对滤液进行操作1获取较纯净的溴苯。
B中发生的氧化还原反应的离子方程式为_______ ,步骤⑤中操作1的名称为_______ 。
(3)若要证明苯和液溴的反应为取代反应,则C中盛放 的作用是
的作用是_______ ,请设计后续实验方案证明苯和液溴的反应为取代反应_______ 。

请回答下列问题:
(1)先向分液漏斗中加入苯和液溴,再将苯和液溴的混合液缓慢滴入反应器A中(A下端活塞处于关闭状态),则A中反应的化学方程式为
(2)通过以下步骤可获取较纯净的溴苯:
①反应结束后打开A下端的活塞,让反应液流入B中;
②充分反应后,将B中液体转移至分液漏斗中,振荡、静置并分液;
③向有机层中加入蒸馏水洗涤,振荡、静置并分液;
④向有机层中加入无水
 粉末干燥并过滤;
粉末干燥并过滤;⑤对滤液进行操作1获取较纯净的溴苯。
B中发生的氧化还原反应的离子方程式为
(3)若要证明苯和液溴的反应为取代反应,则C中盛放
 的作用是
的作用是
您最近一年使用:0次
2023-01-07更新
|
398次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高一下学期第四次月考化学试题
名校
解题方法
10 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至液体是透明的_____ 色,停止加热,即制得Fe(OH)3胶体。用激光笔照射烧杯中的液体,可以看到_____ 。
(2)甲组同学通过研究pH对FeSO4稳定性的影响,得到如图1所示结果,增强Fe2+稳定性的措施为_____ 。
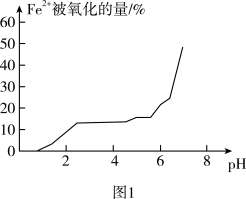
(3)乙组同学为探究Fe2(SO4)3与Cu的反应,进行如图2所示实验:
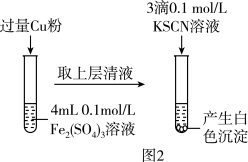
①Fe3+与Cu反应的离子方程式为_____ 。
②为了探究白色沉淀产生的原因,向学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2+4I-=2CuI↓+I2
填写实验方案:
Cu 与SCN-反应的离子方程式为
与SCN-反应的离子方程式为_____ 。
(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。
①方案冲预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,猜想理由是_____ 。
②方案ii中现象是_____ ,则证明口服液中含Fe2+。
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至液体是透明的
(2)甲组同学通过研究pH对FeSO4稳定性的影响,得到如图1所示结果,增强Fe2+稳定性的措施为

(3)乙组同学为探究Fe2(SO4)3与Cu的反应,进行如图2所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,向学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2+4I-=2CuI↓+I2
填写实验方案:
| 实验方案 | 实验现象 |
| 少骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mo/LKSCN溶液 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
 与SCN-反应的离子方程式为
与SCN-反应的离子方程式为(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。
 | 方案 | 试剂X |
| 方案i | 1mL1mol/L酸性KMnO4溶液 | |
| 方案ii | 依次加入5滴KSCN溶液。1mL氨水 |
②方案ii中现象是
您最近一年使用:0次
2023-03-26更新
|
352次组卷
|
2卷引用:河南省南阳镇平一高2023-2024学年高一上学期化学学科训练试题



