1 . 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备TiCl4(夹持装置略去)。
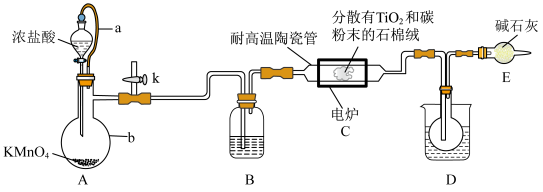
已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如表所示:
请回答下列问题:
(1)装置A中导管a的作用为_______ ,装置B中所盛试剂为_______ ,装置C中生成TiCl4的化学方程式为_______ 。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:_______ 。
_______→_______→b→_______→_______→_______
(3)下列说法不正确的是_______ 。
A.通入氯气之前,必须先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2•yH2O。测定产物xTiO2•yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。通过分析、计算,该样品的组成为_______ 。(填写化学式)

已知:HCl与TiO2不发生反应;装置C中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:
_______→_______→b→_______→_______→_______
(3)下列说法不正确的是
A.通入氯气之前,必须先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2•yH2O。测定产物xTiO2•yH2O组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00mL。通过分析、计算,该样品的组成为
您最近一年使用:0次
2023-09-17更新
|
188次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高三上学期10月月考化学试题
名校
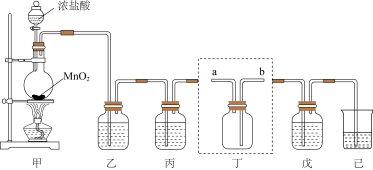
2 . 氯气、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备漂白粉,并收集纯净干燥的氯气。
回答下列问题:
(1)装置甲中发生反应的离子方程式为______ 。
(2)装置乙、丙中盛装的试剂分别为是______ 、______ 。
(3)装置丁用来收集纯净且干燥的氯气,进气口为______ (填“a”或“b”)。
(4)装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为______ 。
(5)漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。
已知: 溶液呈碱性:
溶液呈碱性: ;
;
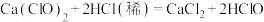
①漂白粉中的 能与空气中的
能与空气中的 和水蒸气反应,从而发生变质,写出该反应的化学方程
和水蒸气反应,从而发生变质,写出该反应的化学方程______ 。
②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是______ 。
③由乙同学的实验可以证明漂白粉______ (填“没有变质”、“部分变质”或“完全变质”)
(6)装置己的作用是吸收多余的氯气,可选用试剂______。(填标号)。

回答下列问题:
(1)装置甲中发生反应的离子方程式为
(2)装置乙、丙中盛装的试剂分别为是
(3)装置丁用来收集纯净且干燥的氯气,进气口为
(4)装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为
(5)漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。
已知:
 溶液呈碱性:
溶液呈碱性: ;
;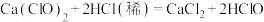
①漂白粉中的
 能与空气中的
能与空气中的 和水蒸气反应,从而发生变质,写出该反应的化学方程
和水蒸气反应,从而发生变质,写出该反应的化学方程②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是
③由乙同学的实验可以证明漂白粉
(6)装置己的作用是吸收多余的氯气,可选用试剂______。(填标号)。
| A.稀硫酸 | B. | C. | D. |
您最近一年使用:0次
2023-12-27更新
|
100次组卷
|
2卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
3 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取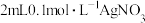 溶液,先后滴加3滴 溶液,先后滴加3滴 溶液和5滴 溶液和5滴 溶液,观察沉淀情况 溶液,观察沉淀情况 | 比较 、 、 的大小 的大小 |
| D | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-01更新
|
801次组卷
|
7卷引用:河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题
河南省南阳市第八中学校2022-2023学年高二上学期线上期末考试化学试题选择性必修1(SJ)专题3专题综合检测(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷河南省中原名校2021-2022学年高二上学期期末联考化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
4 . 下列有关实验现象及结论等叙述正确的有
①向溶有 的
的 溶液中通入气体
溶液中通入气体 ,出现白色沉淀,说明
,出现白色沉淀,说明 具有碱性
具有碱性
②将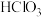 滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:
滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有
④向 溶液加新制氯水,再加入少量
溶液加新制氯水,再加入少量 溶液,溶液变为红色,
溶液,溶液变为红色, 溶液中一定含有
溶液中一定含有
⑤向饱和 溶液中滴加硼酸,无气泡产生,非金属性:
溶液中滴加硼酸,无气泡产生,非金属性:
⑥取少量 样品溶于稀硫酸,滴入
样品溶于稀硫酸,滴入 溶液,溶液变红色,证明样品已变质
溶液,溶液变红色,证明样品已变质
①向溶有
 的
的 溶液中通入气体
溶液中通入气体 ,出现白色沉淀,说明
,出现白色沉淀,说明 具有碱性
具有碱性②将
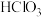 滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:
滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有

④向
 溶液加新制氯水,再加入少量
溶液加新制氯水,再加入少量 溶液,溶液变为红色,
溶液,溶液变为红色, 溶液中一定含有
溶液中一定含有
⑤向饱和
 溶液中滴加硼酸,无气泡产生,非金属性:
溶液中滴加硼酸,无气泡产生,非金属性:
⑥取少量
 样品溶于稀硫酸,滴入
样品溶于稀硫酸,滴入 溶液,溶液变红色,证明样品已变质
溶液,溶液变红色,证明样品已变质| A.0条 | B.1条 | C.2条 | D.3条 |
您最近一年使用:0次
2021-11-16更新
|
260次组卷
|
3卷引用:河南省南阳市2022届高三上学期期中考试化学试题
河南省南阳市2022届高三上学期期中考试化学试题(已下线)第13练 元素周期律-2022年【寒假分层作业】高一化学(人教版2019)江西省丰城市第九中学2021-2022学年高三上学期复读班第三次月考 化学试卷
5 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用如图所示装置制备干燥纯净的氯气并收集,请回答下列问题。

(1)I中所盛试剂为__ (填序号,下同),II中所盛试剂为__ 。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→________________ ;收集氯气选择用向下排空气法,相同条件下,氯气的密度与氢气的密度之比为__ 。
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有__ ;
假设2:该漂白粉全部变质,含有__ ;
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。

(1)I中所盛试剂为
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有
假设2:该漂白粉全部变质,含有
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| ①取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则 b. |
| ②向步骤①反应后的试管中滴加1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则 d.若品红溶液不褪色,则 |
您最近一年使用:0次
6 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是___ 。
②B装置出来的气体是否需要干燥___ (填“是”或“否”), 装置B的作用是___ ,反应的化学方程式为___ 。
③D中NaOH溶液的作用___ 。
④装置C中发生反应的化学方程式有_____ 。
⑤实验结束时,读取实验中生成气体的体积时,不合理的是_____ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知氧气的密度为ρg/L,则样品中过氧化钠的质量分数为____ 。
⑦实验完成后E到F之间导管内残留水的体积会使测量结果___ (填“偏大”“偏小”或“不影响”)。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②B装置出来的气体是否需要干燥
③D中NaOH溶液的作用
④装置C中发生反应的化学方程式有
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知氧气的密度为ρg/L,则样品中过氧化钠的质量分数为
⑦实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
名校
7 . 下列有关实验的描述正确的是
| A.向碘化钠稀溶液中加入新制氯水立即生成大量紫黑色固体 |
| B.向分别装有1g Na2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 |
| C.将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 |
| D.中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
您最近一年使用:0次
2017-05-08更新
|
781次组卷
|
7卷引用:河南省南阳市第一中学2018届高三第九次考试理综化学试题
8 . 下列依据相关实验得出的结论正确的是
| A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| B.将Fe(NO3)2样品溶于稀盐酸中,然后滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已氧化变质 |
| C.在食盐试样中加入盐酸和KI溶液,加入淀粉溶液后变蓝,说明食盐试样中可能含有KIO3 |
| D.加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 |
您最近一年使用:0次
2016-12-09更新
|
128次组卷
|
3卷引用:2017届河南省南阳一中高三上第二次月考化学试卷
12-13高三上·河南南阳·阶段练习
名校
9 . . 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________
(2)实验中需加热至恒重的目的是:___________________
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________________
(2)实验中判断沉淀是否完全的方法是____________________________________
方案三:按如图装置进行实验:
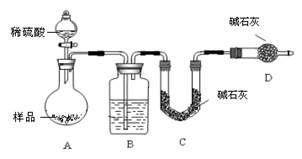
(1)B装置内所盛试剂是_____________ ;D装置的作用是________________ ;分液漏斗中_______ (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为________________ 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是
:__________________________________________
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是
:
您最近一年使用:0次
2016-12-09更新
|
323次组卷
|
3卷引用:2013届河南省南阳市一中高三9月月考理科综合化学试卷
10 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
河南省南阳市六校2023-2024学年高一上学期12月月考化学试题贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐



