1 . 抗肿瘤药Pelitinib的合成
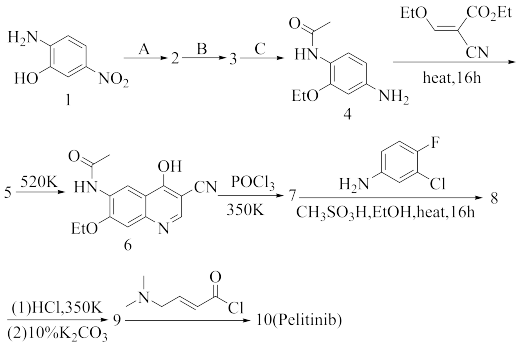
(1)写出上述各步合成反应产物2,3,5,7,8,9,10的结构简式、步骤A,B,C所需的试剂及必要的反应条件_______ 。
(2)化合物4在加热回流条件下与2-氰基-3-乙氧基丙烯酸乙酯反应经中间体5a转化为5,化合物5在250℃条件下经6a,6b中间体得到6:

画出中间体5a,6a,6b的结构简式_______ 。

(1)写出上述各步合成反应产物2,3,5,7,8,9,10的结构简式、步骤A,B,C所需的试剂及必要的反应条件
(2)化合物4在加热回流条件下与2-氰基-3-乙氧基丙烯酸乙酯反应经中间体5a转化为5,化合物5在250℃条件下经6a,6b中间体得到6:

画出中间体5a,6a,6b的结构简式
您最近一年使用:0次
2 . 过渡金属配合物
(1)1966年首次报道了第一个四面体环戊二烯第一过渡金属羰基簇铁的化合物,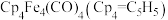 ,为深绿色固体;该簇合物具有对称结构且符合18电子规则,红外光谱表明CO的振动频率特别的低,位于
,为深绿色固体;该簇合物具有对称结构且符合18电子规则,红外光谱表明CO的振动频率特别的低,位于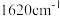 。
。
①指出中心原子符合18电子规则的电子来源_______ 。
②指出中心原子的杂化轨道_______ 。
③写出该分子的配位化学式并画出该分子的空间结构_______ 。
(2)直到1979年才合成出第二个第一过渡金属的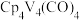 衍生物,为黑色固体。
衍生物,为黑色固体。
①比较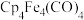 和
和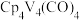 的稳定性
的稳定性_______ 。
②推测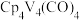 空间结构是否与
空间结构是否与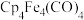 相同,给出理由
相同,给出理由_______ 。
(1)1966年首次报道了第一个四面体环戊二烯第一过渡金属羰基簇铁的化合物,
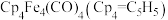 ,为深绿色固体;该簇合物具有对称结构且符合18电子规则,红外光谱表明CO的振动频率特别的低,位于
,为深绿色固体;该簇合物具有对称结构且符合18电子规则,红外光谱表明CO的振动频率特别的低,位于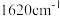 。
。①指出中心原子符合18电子规则的电子来源
②指出中心原子的杂化轨道
③写出该分子的配位化学式并画出该分子的空间结构
(2)直到1979年才合成出第二个第一过渡金属的
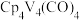 衍生物,为黑色固体。
衍生物,为黑色固体。①比较
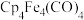 和
和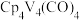 的稳定性
的稳定性②推测
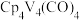 空间结构是否与
空间结构是否与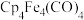 相同,给出理由
相同,给出理由
您最近一年使用:0次
解题方法
3 . 我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
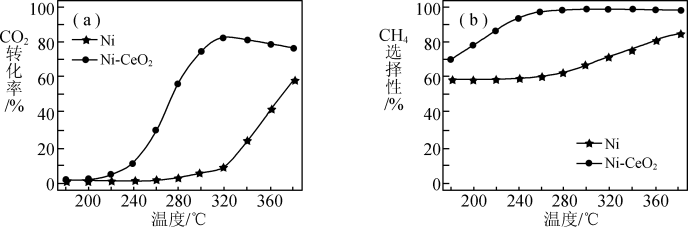
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
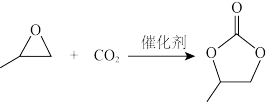 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
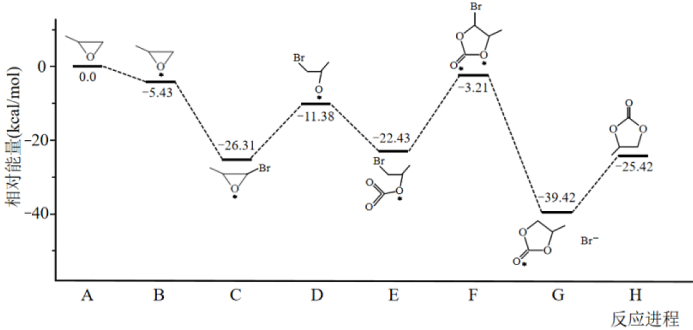
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
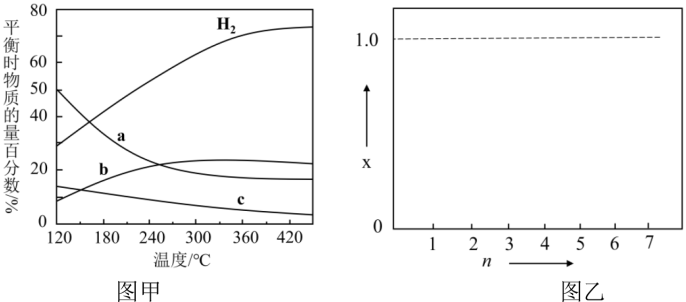
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
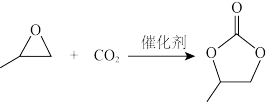 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
4 . 下图是一种染料敏化太阳能电池的示意图,电池的一个电极由吸附光敏染料(D)的TiO2。纳米晶体涂敷在导电玻璃上构成,另一电极由Pt-导电玻璃构成,工作原理为:

①TiO2/D +TiO2/D*(激发态)
+TiO2/D*(激发态)
②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的_______ 极(填“正”或“负”)。
(2)结合图示写出③的离子方程式(其中染料分子用D表示)_______ 。
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k_______ kˊ(填“>”或“<”)。
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)_______ 。
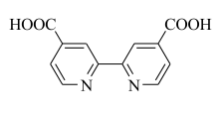
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。
①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类_______ ,n=_______ 。
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式_______ ,其杂化轨道类型为_______ 。
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用 表示
表示_______ 。

①TiO2/D
 +TiO2/D*(激发态)
+TiO2/D*(激发态)②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的
(2)结合图示写出③的离子方程式(其中染料分子用D表示)
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。

①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用
 表示
表示
您最近一年使用:0次
5 . 以FeCl3溶液和不同的强碱弱酸盐溶液作为研究对象,探究盐溶液之间反应的多样性。
(1)①实验I中选用稀盐酸而不用蒸馏水的原因(结合离子方程式解释):_______ 。
②实验I中稀释所得0.1mol/LFeCl3溶液的pH_______ (选填字母序号)。
a.小于1 b.1~2之间 c.大于2
(2)①用光束照射实验II中红褐色液体有丁达尔现象表明其为_______ 分散系。
②取少量实验II中红褐色液体加足量盐酸酸化,再加BaCl2溶液有白色沉淀,由此推断FeCl3溶液与Na2SO3溶液发生反应的离子方程式是_______ 。
(3)一些弱酸的电离常数(Ka)如下表所示
解释实验II和III现象不同的原因:_______ 。
(4)查阅资料:FeS和Fe2S3均为难溶于水的黑色固体,其溶度积常数(Ksp)如下表:
用离子方程式解释实验IV中划线部分现象产生的原因:_______ 。
(5)反思与评价:FeCl3溶液和不同的强碱弱酸盐溶液反应的多样性与_______ 有关(至少答出2种影响因素)。
| 实验 | 现象 |
| I.用FeCl3·6H2O与稀盐酸配制1mol/LFeCl3溶液(pH=1);取部分溶液稀释至0.lmol/L备用 | —— |
| II.取1mL1mol/LFeCl3溶液,加入3mL0.5mol/LNa2SO3溶液 | 黄色溶液转变为红褐色液体 |
| II.取1mL1mol/LFeCl3溶液,加入3mL0.5mol/LNa2CO3溶液 | 迅速产生红褐色沉淀和无色气体 |
| IV.取10mL0.1mol/LFeCl3溶液,滴加0.5mo/LNa2S溶液 | 加入2滴,出现黑色沉淀,振荡后消失,溶液澄清;再加2滴,又出现黑色沉淀,振荡后消失,同时出现少量淡黄色沉淀,并有臭鸡蛋味气体产生 |
(1)①实验I中选用稀盐酸而不用蒸馏水的原因(结合离子方程式解释):
②实验I中稀释所得0.1mol/LFeCl3溶液的pH
a.小于1 b.1~2之间 c.大于2
(2)①用光束照射实验II中红褐色液体有丁达尔现象表明其为
②取少量实验II中红褐色液体加足量盐酸酸化,再加BaCl2溶液有白色沉淀,由此推断FeCl3溶液与Na2SO3溶液发生反应的离子方程式是
(3)一些弱酸的电离常数(Ka)如下表所示
| 化学式 | H2SO3 | H2CO3 | H2S |
| Kal Ka2 | 1.4×10-2 6.3×10-8 | 4.5×10-7 4.7×10-11 | 8.9×10-8 1.2×10-13 |
解释实验II和III现象不同的原因:
(4)查阅资料:FeS和Fe2S3均为难溶于水的黑色固体,其溶度积常数(Ksp)如下表:
| 化学式 | FeS | Fe(OH)3 | Fe2S3 |
| Ksp | 6.3×10-18 | 2.8×10-39 | ~10-88 |
用离子方程式解释实验IV中划线部分现象产生的原因:
(5)反思与评价:FeCl3溶液和不同的强碱弱酸盐溶液反应的多样性与
您最近一年使用:0次
6 . 钨被誉为“工业的牙齿”,由仲钨酸铵[(NH4)10H2W12O42·4H2O]煅烧可得黄钨(WO3)、蓝钨(WO2.9)、紫钨(WO2.72)等。
(1)写出仲钨酸铵分解制取黄钨的反应方程式_______ 。
(2)试解释煅烧过程中生成蓝钨和紫钨的原因_______ 。
(3)钨的一种硫化物具有类似石墨的层状结构,在催化剂、能量储存、锂电池、润滑剂等方面有广泛应用。它可由黄钨与硫粉反应后经气相沉积结晶而成。该硫化钨的一种结构如图,每W原子与6个S原子以共价键相结合,形成三棱柱配位;每个S原子与3个W原子以共价键相结合,形成三棱锥配位。

①写出该硫化钨化学式_______ 。
②写出生成该硫化钨的化学方程式_______ 。
③简述该硫化钨能用做润滑剂的原因_______ 。
(1)写出仲钨酸铵分解制取黄钨的反应方程式
(2)试解释煅烧过程中生成蓝钨和紫钨的原因
(3)钨的一种硫化物具有类似石墨的层状结构,在催化剂、能量储存、锂电池、润滑剂等方面有广泛应用。它可由黄钨与硫粉反应后经气相沉积结晶而成。该硫化钨的一种结构如图,每W原子与6个S原子以共价键相结合,形成三棱柱配位;每个S原子与3个W原子以共价键相结合,形成三棱锥配位。

①写出该硫化钨化学式
②写出生成该硫化钨的化学方程式
③简述该硫化钨能用做润滑剂的原因
您最近一年使用:0次
7 . 利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示。T-碳的密度非常小,约为金刚石的一半。下列说法正确的是


| A.T-碳与金刚石互为同素异形体 |
| B.一个T-碳晶胞中含有32个碳原子 |
| C.T-碳晶胞的边长和金刚石晶胞的边长之比为1:2 |
| D.T-碳的硬度比金刚石小 |
您最近一年使用:0次
2021-07-12更新
|
920次组卷
|
2卷引用:第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题
8 . 按碳正离子稳定性由大到小排列的顺序是


| A.cadb | B.cdab | C.acdb | D.dcab |
您最近一年使用:0次
9 . 在6℃时Q在苯和水中的分配情况见表。表中cB和cw分别表示Q在苯和水中的平衡浓度,从表中数据计算发现 几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
 几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是
几乎是一个常数。假定Q在苯中的物种是唯一的。并与温度、浓度无关,进一步假定Q在水中是单体,Q在苯中的存在形式是| cB(mol·L-1) | cW(mol·L-1) | cB (mol·L-1) | cw (mol·L-1) |
| 0.0118 | 0.00281 | 0.0981 | 0.00812 |
| 0.0478 | 0.00566 | 0.156 | 0.0102 |
| A.单体 | B.二聚体 | C.三聚体 | D.无法计算 |
您最近一年使用:0次
10 . 卡尔-费休法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N, 有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。下列说法错误的是
A.该方法的基本原理是利用碘与二氧化硫反应,离子方程式为:I2+ SO2 + 2H2O =2H+ +SO + 2HI + 2HI |
| B.加入吡啶的作用是中和产生的酸,促进反应进行完全 |
| C.加入甲醇可以进一步稳定产物, 生成C5H5NHSO4CH3 |
| D.总反应可表示为:I2+SO2+H2O+3C5H5N+CH3OH=C5H5NHSO4CH3+2C5H5NHI |
您最近一年使用:0次



