1 . 酸碱性与结构
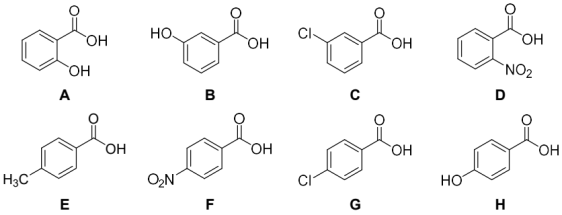
(1)请按酸性从强到弱给以下化合物排序:_______ 。
(2)请分别按碱性从强到弱给下列两组化合物排序:_______ 。
①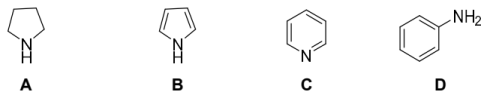
②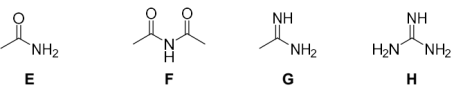
(1)请按酸性从强到弱给以下化合物排序:

(2)请分别按碱性从强到弱给下列两组化合物排序:
①

②

您最近一年使用:0次
2 . 光刻胶
化合物E是一种负型光致抗蚀剂(又称光刻胶),大量用于印刷制版和电子工业的光刻技术中。其合成方法如下:
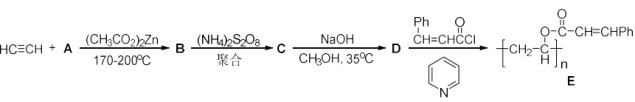
(1)用结构简式表示A,B,C,D的结构_______ 、_______ 、_______ 、_______ 。
(2)光刻制版时,光刻胶E在紫外光照射下生成F,溶解度下降。不见光的部分不反应,用溶剂溶解后得到影像。画出F的结构简式_______ 。
化合物E是一种负型光致抗蚀剂(又称光刻胶),大量用于印刷制版和电子工业的光刻技术中。其合成方法如下:

(1)用结构简式表示A,B,C,D的结构
(2)光刻制版时,光刻胶E在紫外光照射下生成F,溶解度下降。不见光的部分不反应,用溶剂溶解后得到影像。画出F的结构简式
您最近一年使用:0次
3 . 环辛四烯及其双负离子
环辛四烯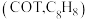 最稳定的结构为船型,与钾作用还原可得平面结构的环辛四烯双负离子
最稳定的结构为船型,与钾作用还原可得平面结构的环辛四烯双负离子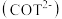 。
。
(1)简要解释环辛四烯与其双负离子具有不同稳定构型的原因_______ 。
(2)封闭的圆环中粒子的能级为: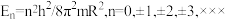 。式中n为描述能级的量子数,R是圆环的半径。m、h分别为电子的质量和Planck常数。若环辛四烯双负离子
。式中n为描述能级的量子数,R是圆环的半径。m、h分别为电子的质量和Planck常数。若环辛四烯双负离子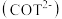 的离域
的离域 电子可近似描述为圆环中粒子,取
电子可近似描述为圆环中粒子,取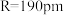 ,试求其电子基态跃起到第一激发态所吸收光的波长
,试求其电子基态跃起到第一激发态所吸收光的波长_______ 。
环辛四烯
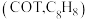 最稳定的结构为船型,与钾作用还原可得平面结构的环辛四烯双负离子
最稳定的结构为船型,与钾作用还原可得平面结构的环辛四烯双负离子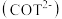 。
。(1)简要解释环辛四烯与其双负离子具有不同稳定构型的原因
(2)封闭的圆环中粒子的能级为:
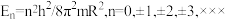 。式中n为描述能级的量子数,R是圆环的半径。m、h分别为电子的质量和Planck常数。若环辛四烯双负离子
。式中n为描述能级的量子数,R是圆环的半径。m、h分别为电子的质量和Planck常数。若环辛四烯双负离子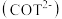 的离域
的离域 电子可近似描述为圆环中粒子,取
电子可近似描述为圆环中粒子,取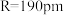 ,试求其电子基态跃起到第一激发态所吸收光的波长
,试求其电子基态跃起到第一激发态所吸收光的波长
您最近一年使用:0次
4 . 立方晶系二元合金
有一立方晶系二元合金,单胞参数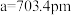 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体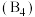 ,已知晶胞中
,已知晶胞中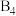 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
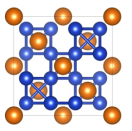
(1)写出二元合金的化学式_______ 。
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度_______ 。
(3)晶胞的单位点阵型式_______ 。
(4)实际上,大部分该类结构二元合金的原子半径比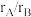 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和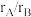 值
值_______ 、_______ 。
有一立方晶系二元合金,单胞参数
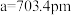 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体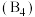 ,已知晶胞中
,已知晶胞中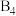 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
(1)写出二元合金的化学式
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度
(3)晶胞的单位点阵型式
(4)实际上,大部分该类结构二元合金的原子半径比
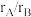 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和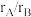 值
值
您最近一年使用:0次
解题方法
5 . 氟及化合物
(1)德国人斯瓦恩哈德是从事玻璃加工的一名工人。1670年,他无意中将萤石与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。写出上述化学反应方程式_______ 。
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。终于,1886年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。写出电解制备单质氟的反应方程式_______ 。
(3)又过了整整一百年,化学方法制取F2获得成功。其步骤如下:在 存在下,用
存在下,用 氧化
氧化 ;
; 和HF反应;
和HF反应;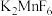 和
和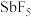 反应。写出各步的化学反应方程式
反应。写出各步的化学反应方程式_______ 、_______ 、_______ 。
(4)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
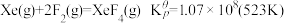 ,
,
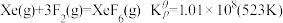 ,
,
XeF6的立方晶型中有四聚体单元, 与其中5个F的键长为
与其中5个F的键长为 ,与第6个F的键长为
,与第6个F的键长为 。
。
①在满足反应速率的前题下,应如何控制温度才有利于 的生成
的生成_______ 。
②若在523K下以Xe和F2制取XeF6,并使产物中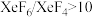 ,计算说明F2的平衡分压至少应保持在标准压力的
,计算说明F2的平衡分压至少应保持在标准压力的_______ 倍(精确到小数点后第一位)?
③指出XeF6气体的分子构型_______ 。
④说明XeF6晶体中存在着什么样的离子_______ ?画出正离子的构型简图_______ 。
⑤按照电子理论,将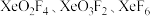 酸性从大到小的顺序排列
酸性从大到小的顺序排列_______ 。
(5)法国科学家盖·吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,但是却意外地制成了一种所谓的“氟酸气”A。气体A可与 发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式
发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式_______ ,画B的结构简图_______ ;将A通入碳酸钠溶液也可发生反应,写出离子反应方程式_______ 。
(6)氟与硼可形成一系列硼的低卤化物,如,具有平面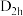 结构的
结构的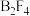 、类似乙硼烷结构的
、类似乙硼烷结构的 ,画出
,画出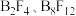 的结构简图
的结构简图_______ 、_______ 。
(7)在 溶液中加入
溶液中加入 ,然后再加入
,然后再加入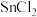 ,通过计算说明能否发生氧化还原反应
,通过计算说明能否发生氧化还原反应_______ 。(已知 ,
, ,
, ,设有关物质的浓度都为
,设有关物质的浓度都为 )。
)。
(1)德国人斯瓦恩哈德是从事玻璃加工的一名工人。1670年,他无意中将萤石与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。写出上述化学反应方程式
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。终于,1886年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。写出电解制备单质氟的反应方程式
(3)又过了整整一百年,化学方法制取F2获得成功。其步骤如下:在
 存在下,用
存在下,用 氧化
氧化 ;
; 和HF反应;
和HF反应;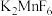 和
和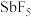 反应。写出各步的化学反应方程式
反应。写出各步的化学反应方程式(4)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
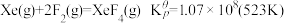 ,
,
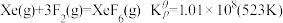 ,
,
XeF6的立方晶型中有四聚体单元,
 与其中5个F的键长为
与其中5个F的键长为 ,与第6个F的键长为
,与第6个F的键长为 。
。①在满足反应速率的前题下,应如何控制温度才有利于
 的生成
的生成②若在523K下以Xe和F2制取XeF6,并使产物中
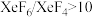 ,计算说明F2的平衡分压至少应保持在标准压力的
,计算说明F2的平衡分压至少应保持在标准压力的③指出XeF6气体的分子构型
④说明XeF6晶体中存在着什么样的离子
⑤按照电子理论,将
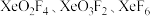 酸性从大到小的顺序排列
酸性从大到小的顺序排列(5)法国科学家盖·吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,但是却意外地制成了一种所谓的“氟酸气”A。气体A可与
 发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式
发生反应,生成多卤阳离子B和一四面体阴离子C,写出离子反应方程式(6)氟与硼可形成一系列硼的低卤化物,如,具有平面
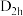 结构的
结构的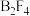 、类似乙硼烷结构的
、类似乙硼烷结构的 ,画出
,画出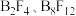 的结构简图
的结构简图(7)在
 溶液中加入
溶液中加入 ,然后再加入
,然后再加入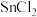 ,通过计算说明能否发生氧化还原反应
,通过计算说明能否发生氧化还原反应 ,
, ,
, ,设有关物质的浓度都为
,设有关物质的浓度都为 )。
)。
您最近一年使用:0次
6 . 某地出产的矿石A可看作由主要成分硅酸铜盐X·7H2O (摩尔质量=406 g·mol-1 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
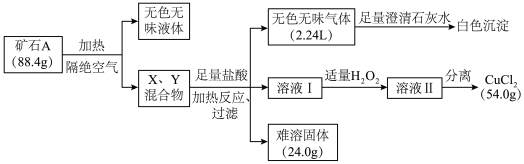
请回答:
(1)写出Y中除氧以外的元素符号_________ ,X的化学式为________ 。
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式________ ; 加足量H2O2后对溶液II进行分离,可得到该元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式________ 。
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式________ 。
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成__________ 。

请回答:
(1)写出Y中除氧以外的元素符号
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成
您最近一年使用:0次
7 . 高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2O CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______ mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
CoCl2+H2O
 CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为
您最近一年使用:0次
8 . 请回答下列问题。
(1)金属铝的卤化物熔点如下表:
请画出其中不属于分子晶体的卤化铝的电子式_______ ,加热分解某种铵盐X,可以1:3的物质的量比获得该卤化铝与一种离子化合物Y,Y的阳离子与阴离子具有相同的核外电子数,写出X的化学式_______ 。
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因________ 。
(1)金属铝的卤化物熔点如下表:
| 化学式 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/°C | 1290 | 180 | 97.5 | 188 |
请画出其中不属于分子晶体的卤化铝的电子式
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因
您最近一年使用:0次
解题方法
9 . 利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,实现高效工作,其作用原理图示如下:
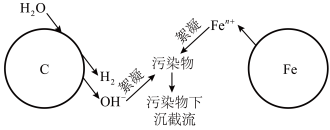
请回答:
(1)写出铁电极上电极方程式_________ 。
(2)下列叙述正确的是。
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,写出相关的离子方程式_______ 。
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水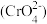 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为________ (以铬元素的量计算)。

请回答:
(1)写出铁电极上电极方程式
(2)下列叙述正确的是。
| A.铁电极为正极,碳电极为负极 |
| B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污 |
| C.碳电极上的反应环境为无溶解氧环境 |
| D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面 |
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水
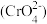 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
您最近一年使用:0次
解题方法
10 . 将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50°C时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
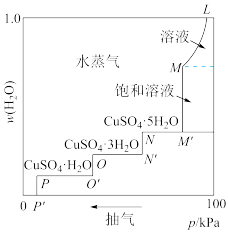

| A.由图可推测五水硫酸铜中,五个结晶水的化学环境不完全相同 |
| B.曲线M-M′对应溶液溶质的质量分数保持不变 |
C.曲线M′-N对应体系存在平衡:CuSO4(饱和溶液) CuSO4·5H2O(s)+ H2O(g) CuSO4·5H2O(s)+ H2O(g) |
| D.当容器中压强低于p′后得到无水硫酸铜 |
您最近一年使用:0次



