解题方法
1 . 实验室现有质量分数为36.5%、密度为1.19g·cm-3的浓盐酸,回答下列问题:
(1)浓盐酸的物质的量浓度为___________ mol·L-1。
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取___________ mL的浓盐酸,量取浓盐酸所用的量筒的规格为___________ (填标号)。
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有___________ 。
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:___________ (填“偏大”“偏小”或“无影响”,下同)。
②将溶液注入未经干燥的容量瓶中。___________
③转移溶液时用过的烧杯、玻璃棒未洗涤:___________ 。
④定容时俯视刻度线:___________ 。
⑤量取浓盐酸时仰视刻度线:___________
(1)浓盐酸的物质的量浓度为
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:
②将溶液注入未经干燥的容量瓶中。
③转移溶液时用过的烧杯、玻璃棒未洗涤:
④定容时俯视刻度线:
⑤量取浓盐酸时仰视刻度线:
您最近一年使用:0次
2 . 请根据要求填空:
(1)工业上常用Fe2+处理含Cr2O 的酸性废水,请写出该反应的离子方程式:
的酸性废水,请写出该反应的离子方程式:___________ 。
(2)实验中常用足量的氢氧化钙溶液检验CO2气体。请写出该反应的离子方程式:___________ 。
(3)黑火药是我国古代的四大发明之一、黑火药着火时,主要发生化学反应:2KNO3+S+3C=K2S+N2↑+3CO2↑。在上述反应中,被还原的元素为(填元素符号)___________ 。
(4)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆ClO2。其变化可表示为:KClO3+HCl(浓)→KCl+ClO2↑+Cl2↑+H2O
①请完成该化学方程式并配平___________ ;
②浓盐酸在反应中显示出来的性质是___________ 。标准状况下,产生33.6L的Cl2,则转移的电子的物质的量为___________ mol。
(1)工业上常用Fe2+处理含Cr2O
 的酸性废水,请写出该反应的离子方程式:
的酸性废水,请写出该反应的离子方程式:(2)实验中常用足量的氢氧化钙溶液检验CO2气体。请写出该反应的离子方程式:
(3)黑火药是我国古代的四大发明之一、黑火药着火时,主要发生化学反应:2KNO3+S+3C=K2S+N2↑+3CO2↑。在上述反应中,被还原的元素为(填元素符号)
(4)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆ClO2。其变化可表示为:KClO3+HCl(浓)→KCl+ClO2↑+Cl2↑+H2O
①请完成该化学方程式并配平
②浓盐酸在反应中显示出来的性质是
您最近一年使用:0次
解题方法
3 . 在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,固体完全溶解,溶液的物质的量浓度关系正确的是
| A.丁<甲<乙=丙 | B.甲=丁<乙=丙 | C.甲>丁>乙>丙 | D.丁<甲<乙<丙 |
您最近一年使用:0次
解题方法
4 . 碳氧化物一直以来都是工业发展的重要组成物质,根据下列信息填空:
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1
②CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205 kJ·mol-1
则CO2重整的热化学方程式为___________ 。
(2)利用反应CO(g)+H2O(g) H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。
①该反应化学平衡常数表达式K=___________ 。
②该反应的平衡常数随温度的变化如表:
从上表可以推断:此反应是___________ (填“吸热”或“放热”)反应。
③830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内 (CO2)=
(CO2)=___________ ,此时反应进行的方向是___________ ,依据是___________ ,可以判断该反应达到平衡的标志是___________ (填字母)。
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1
②CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205 kJ·mol-1
则CO2重整的热化学方程式为
(2)利用反应CO(g)+H2O(g)
 H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。①该反应化学平衡常数表达式K=
②该反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
③830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol。2min内
 (CO2)=
(CO2)=a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
您最近一年使用:0次
解题方法
5 . 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
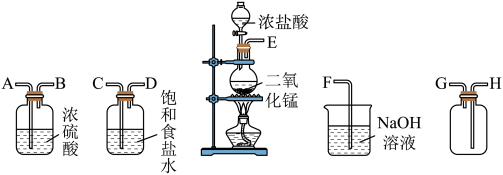
(1)上述仪器的正确连接顺序为(填各接口处的字母):___________ 。
(2)装置中,饱和食盐水的作用是___________ ;NaOH溶液的作用是___________ 。
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___________ ,反应的化学方程式为___________ 。
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:___________ ;
②NaOH溶液中发生反应的化学方程式:___________ 。
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)___________ 。( )
)

(1)上述仪器的正确连接顺序为(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:
②NaOH溶液中发生反应的化学方程式:
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)
 )
)
您最近一年使用:0次
解题方法
6 . 室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO 、Cl- 、Cl- |
B.0.1 mol·L-1 FeCl2溶液:K+、SO 、OH- 、OH- |
| C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH- |
D.0.1 mol·L-1 H2SO4的溶液:K+、Cl-、CH3COO-、NH |
您最近一年使用:0次
解题方法
7 . 根据要求和所给条件,书写反应方程式(系数为最简整数比)。
(1)碳化铝(Al4C3)与水反应_____ 。
(2)乙酸酐与Mn(NO3)2•6H2O反应制备无水盐Mn(CH3COO)3_____ 。
(3)在真空和900℃下于钼舟中用TiO2与CaH2反应制备金属Ti_____ 。
(4)在约200℃下NaNH2与笑气反应制备叠氮化物_____ 。
(5)SeCl4与无水液氨作用转化为爆炸性很强的化合物Se4N4_____ 。
(1)碳化铝(Al4C3)与水反应
(2)乙酸酐与Mn(NO3)2•6H2O反应制备无水盐Mn(CH3COO)3
(3)在真空和900℃下于钼舟中用TiO2与CaH2反应制备金属Ti
(4)在约200℃下NaNH2与笑气反应制备叠氮化物
(5)SeCl4与无水液氨作用转化为爆炸性很强的化合物Se4N4
您最近一年使用:0次
8 . Ⅰ.请画出下列反应产物的结构简式:
(1)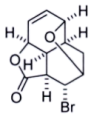

_________
(2)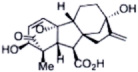
_________
(3)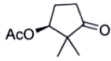
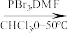
_________
(4)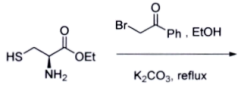
_________
(5)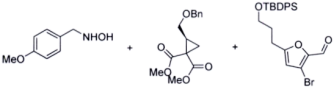
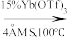
_________
(6)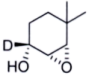
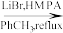
_________
(7)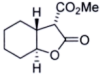
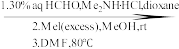
_________
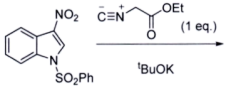
(8)
_________
(9)(TBDMS:叔丁基二甲基硅基:Tf:三氟甲磺酰基)
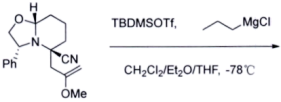
_________
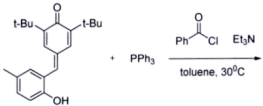
(10)
_________
Ⅱ.请画出下列反应的产物及其中间体的结构简式。
(11)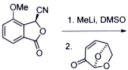
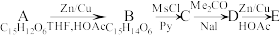
_________
(12)(TBDPS:特丁基二苯基硅基;TBAF:四正丁基氟化铵:Oct:正辛基)_________
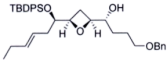
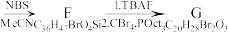
(1)


(2)

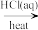
(3)

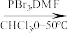
(4)

(5)

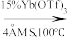
(6)

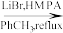
(7)

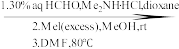
(8)

(9)(TBDMS:叔丁基二甲基硅基:Tf:三氟甲磺酰基)

(10)

Ⅱ.请画出下列反应的产物及其中间体的结构简式。
(11)

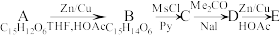
(12)(TBDPS:特丁基二苯基硅基;TBAF:四正丁基氟化铵:Oct:正辛基)

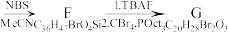
您最近一年使用:0次
解题方法
9 . 马来酸二丁酯(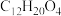 )是粘接剂行业的一种优良增塑剂,也在很多有机合成中用作添加剂和中间体。研究者用离子交换树脂AmberliteIR-120作为催化剂,催化顺丁烯二酸酐(
)是粘接剂行业的一种优良增塑剂,也在很多有机合成中用作添加剂和中间体。研究者用离子交换树脂AmberliteIR-120作为催化剂,催化顺丁烯二酸酐(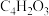 ,记为A)与正丁醇(
,记为A)与正丁醇(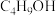 ,记为B)的酯化反应来合成马来酸二丁酯。实验获得如下动力学数据:
,记为B)的酯化反应来合成马来酸二丁酯。实验获得如下动力学数据:
已知速率方程式为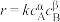 。
。
(1)试导出 、
、 的值。
的值。 =
=________ , =
=________ ,
(2)计算反应的速率常数k及反应的活化能 。k=
。k=________ ,
________ ,
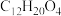 )是粘接剂行业的一种优良增塑剂,也在很多有机合成中用作添加剂和中间体。研究者用离子交换树脂AmberliteIR-120作为催化剂,催化顺丁烯二酸酐(
)是粘接剂行业的一种优良增塑剂,也在很多有机合成中用作添加剂和中间体。研究者用离子交换树脂AmberliteIR-120作为催化剂,催化顺丁烯二酸酐(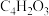 ,记为A)与正丁醇(
,记为A)与正丁醇(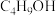 ,记为B)的酯化反应来合成马来酸二丁酯。实验获得如下动力学数据:
,记为B)的酯化反应来合成马来酸二丁酯。实验获得如下动力学数据:| 序号 | 反应温度/℃ |  |  | 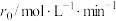 |
| 1 | 115 | 0.303 | 0.606 | 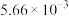 |
| 2 | 115 | 0.454 | 0.606 | 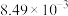 |
| 3 | 115 | 0.303 | 0.910 | 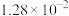 |
| 4 | 110 | 0.454 | 0.606 | 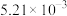 |
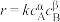 。
。(1)试导出
 、
、 的值。
的值。 =
= =
=(2)计算反应的速率常数k及反应的活化能
 。k=
。k=
您最近一年使用:0次
10 . 有一个可逆热机以10mol理想气体 为工作物质,从始态经过如下4个连续的可遵循环过程:①使
为工作物质,从始态经过如下4个连续的可遵循环过程:①使 气与高温热源
气与高温热源 接触进行等温可逆膨胀,体积增大一倍,气体从高温热源
接触进行等温可逆膨胀,体积增大一倍,气体从高温热源 吸收
吸收 的热量,对外做功;②让
的热量,对外做功;②让 气离开高温热源使其进行绝热可逆膨胀对外继续做功,
气离开高温热源使其进行绝热可逆膨胀对外继续做功, 气温降低至低温热源的温度
气温降低至低温热源的温度 ;③将气体在低温热源
;③将气体在低温热源 温度下进行等温可逆压缩至下一步使气体经绝热可逆压缩刚好能回到始态;④
温度下进行等温可逆压缩至下一步使气体经绝热可逆压缩刚好能回到始态;④ 气绝热可逆压缩回到始态。循环过程中可逆热机从高温热源吸热
气绝热可逆压缩回到始态。循环过程中可逆热机从高温热源吸热 ,体系做总功W(环境对体系做功为正)。通常采用热机效率
,体系做总功W(环境对体系做功为正)。通常采用热机效率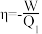 ,来衡量一个热机对外做功的能力。
,来衡量一个热机对外做功的能力。
(1)试导出热机效率 与高、低温热源温度
与高、低温热源温度 、
、 的关系。
的关系。_________
(2)若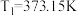 ,
, ,计算热机的效率
,计算热机的效率 以及在一次可遵循环中热机从高温热源
以及在一次可遵循环中热机从高温热源 吸取的热
吸取的热 和所作的功W。
和所作的功W。________
 为工作物质,从始态经过如下4个连续的可遵循环过程:①使
为工作物质,从始态经过如下4个连续的可遵循环过程:①使 气与高温热源
气与高温热源 接触进行等温可逆膨胀,体积增大一倍,气体从高温热源
接触进行等温可逆膨胀,体积增大一倍,气体从高温热源 吸收
吸收 的热量,对外做功;②让
的热量,对外做功;②让 气离开高温热源使其进行绝热可逆膨胀对外继续做功,
气离开高温热源使其进行绝热可逆膨胀对外继续做功, 气温降低至低温热源的温度
气温降低至低温热源的温度 ;③将气体在低温热源
;③将气体在低温热源 温度下进行等温可逆压缩至下一步使气体经绝热可逆压缩刚好能回到始态;④
温度下进行等温可逆压缩至下一步使气体经绝热可逆压缩刚好能回到始态;④ 气绝热可逆压缩回到始态。循环过程中可逆热机从高温热源吸热
气绝热可逆压缩回到始态。循环过程中可逆热机从高温热源吸热 ,体系做总功W(环境对体系做功为正)。通常采用热机效率
,体系做总功W(环境对体系做功为正)。通常采用热机效率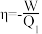 ,来衡量一个热机对外做功的能力。
,来衡量一个热机对外做功的能力。(1)试导出热机效率
 与高、低温热源温度
与高、低温热源温度 、
、 的关系。
的关系。(2)若
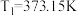 ,
, ,计算热机的效率
,计算热机的效率 以及在一次可遵循环中热机从高温热源
以及在一次可遵循环中热机从高温热源 吸取的热
吸取的热 和所作的功W。
和所作的功W。
您最近一年使用:0次



