1 . “匹伐他汀钙(M)”是一种用来降低胆固醇的新型他汀类药物,因其使用剂量小,耐受性好,安全性高被称为“超级他汀类药物(Superstatin)”,其合成路线如下:
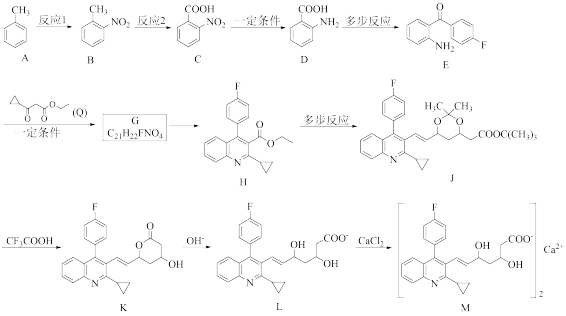
已知:苯环上原有的取代基对新进入取代基与苯环相连的位置有显著影响, 是邻、对位定位基团,-COOH是间位定位基团。
是邻、对位定位基团,-COOH是间位定位基团。
回答下列问题:
(1)E的分子式为_______ ,C→D的反应类型为_______ 。
(2)A→B反应的化学方程式为_______ 。
(3)不能将反应1和反应2顺序颠倒的原因为_______ 。
(4)G含有3个六元环,1mol的G转化成H需要脱去2mol水,G的结构简式是_______ 。
(5)酸性:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(6)若X的分子式比Q少2个C原子和4个H原子,则满足以下条件的X的同分异构体有_______ 种(不考虑立体异构);
i.无环状结构
ii.能发生银镜反应
iii.能和碳酸氢钠溶液反应生成
其中,核磁共振氢谱显示有3组峰,且峰面积之比为3:3:1:1,则该结构简式为_______ 。

已知:苯环上原有的取代基对新进入取代基与苯环相连的位置有显著影响,
 是邻、对位定位基团,-COOH是间位定位基团。
是邻、对位定位基团,-COOH是间位定位基团。回答下列问题:
(1)E的分子式为
(2)A→B反应的化学方程式为
(3)不能将反应1和反应2顺序颠倒的原因为
(4)G含有3个六元环,1mol的G转化成H需要脱去2mol水,G的结构简式是
(5)酸性:

 (填“大于”或“小于”)。
(填“大于”或“小于”)。(6)若X的分子式比Q少2个C原子和4个H原子,则满足以下条件的X的同分异构体有
i.无环状结构
ii.能发生银镜反应
iii.能和碳酸氢钠溶液反应生成

其中,核磁共振氢谱显示有3组峰,且峰面积之比为3:3:1:1,则该结构简式为
您最近一年使用:0次
解题方法
2 . 离子液体是指在室温附近呈液态的全部由离子构成的物质,也称室温熔融盐。离子液体有许多传统溶剂无法比拟的独特性能,广泛应用于化学研究的各个领域。1-丁基-3-甲基咪唑六氟磷酸盐(简称BMIM,结构如图)是一种常见的离子液体,熔点为6.5 ℃,可代替有机溶剂用于酶促酯合成以及其它环境友好的反应。请回答下列问题:
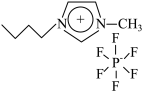
(1)基态磷原子价电子排布图为_________ 。
(2)N、F、P三种元素第一电离能由大到小顺序为______ 。
(3)已知分子中的大 键可用符号
键可用符号
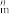 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则BMIM中的大
键的电子数,则BMIM中的大 键可表示为
键可表示为_____ 。
(4)离子晶体的熔点一般较高,如氯化钠的熔点为801 oC,而离子液体的熔点一般低于150℃。结合BMIM的结构分析离子液体的熔点一般较低的原因:______ 。
(5)下列有关离子液体的叙述正确的是______ 。
a.离子液体具有良好的导电性,可以作为电池的电解质
b.离子液体中含有离子键、共价键、配位键和氢键等化学键
c.离子液体与传统溶剂相比具有难挥发的优点,是一种“绿色”溶剂
d.通过改变阳离子、阴离子的不同组合,可以设计合成出不同的离子液体
e.离子液体对有机物有良好的溶解性能,而对无机物的溶解性能较差
(6)化学家发现一种组成为N4H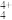 的阳离子,其结构中N原子均为sp3杂化,请推测N4H
的阳离子,其结构中N原子均为sp3杂化,请推测N4H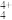 的结构式:
的结构式:__________ 。
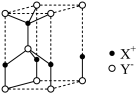
(7)某种离子液体低温下的晶胞结构如图所示。已知该晶体的密度为ρg/cm3,X+和Y-半径分别为a pm、b pm,X、Y的相对原子质量分别用M(X)、M(Y)表示,阿伏加德罗常数的数值为NA。该晶胞中离子的体积占晶胞体积的百分率为________ (列式即可)

(1)基态磷原子价电子排布图为
(2)N、F、P三种元素第一电离能由大到小顺序为
(3)已知分子中的大
 键可用符号
键可用符号
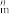 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则BMIM中的大
键的电子数,则BMIM中的大 键可表示为
键可表示为(4)离子晶体的熔点一般较高,如氯化钠的熔点为801 oC,而离子液体的熔点一般低于150℃。结合BMIM的结构分析离子液体的熔点一般较低的原因:
(5)下列有关离子液体的叙述正确的是
a.离子液体具有良好的导电性,可以作为电池的电解质
b.离子液体中含有离子键、共价键、配位键和氢键等化学键
c.离子液体与传统溶剂相比具有难挥发的优点,是一种“绿色”溶剂
d.通过改变阳离子、阴离子的不同组合,可以设计合成出不同的离子液体
e.离子液体对有机物有良好的溶解性能,而对无机物的溶解性能较差
(6)化学家发现一种组成为N4H
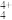 的阳离子,其结构中N原子均为sp3杂化,请推测N4H
的阳离子,其结构中N原子均为sp3杂化,请推测N4H 的结构式:
的结构式:(7)某种离子液体低温下的晶胞结构如图所示。已知该晶体的密度为ρg/cm3,X+和Y-半径分别为a pm、b pm,X、Y的相对原子质量分别用M(X)、M(Y)表示,阿伏加德罗常数的数值为NA。该晶胞中离子的体积占晶胞体积的百分率为

您最近一年使用:0次
3 . 氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域,合成氨工业极大地影响了人类的发展历程。
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式__________ 。
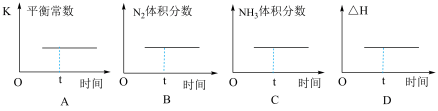
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是______ 。
(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=___________ (用含有P0的式子表示。KP为分压平衡常数,气体分压=气体总压强×该气体的体积分数)
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是_________ 。
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:
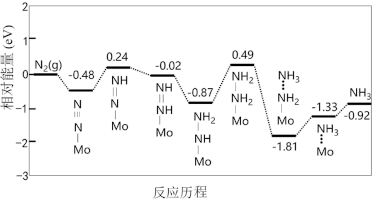
该反应历程中需要吸收能量的最大能垒(活化能)E=__________ eV。
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:_________ 。

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH ) + c(H+)
) + c(H+)____ c(NH3∙H2O) + c(OH-) (NH3∙H2O的Kb=1.8×10-5)
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是

(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:

该反应历程中需要吸收能量的最大能垒(活化能)E=
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH
 ) + c(H+)
) + c(H+)
您最近一年使用:0次
名校
4 . (1)绿色食品是指( )
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.附加值高的营养食品 D.安全、无公害的营养食品
(2)下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
A.腐败食品 B.电池 C.卫生纸 D.纯棉纺织品
(3)葡萄糖能发生银镜反应说明其结构中含有_________ 基。
(4)维生素C可以与酸性高锰酸钾溶液反应,高锰酸钾中的锰元素生成正二价锰离子,那么维生素C发生了____________ (填“氧化”或“还原” )反应
(5)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和____________ (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(6)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身_______ (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式__________________________ 。
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.附加值高的营养食品 D.安全、无公害的营养食品
(2)下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是
A.腐败食品 B.电池 C.卫生纸 D.纯棉纺织品
(3)葡萄糖能发生银镜反应说明其结构中含有
(4)维生素C可以与酸性高锰酸钾溶液反应,高锰酸钾中的锰元素生成正二价锰离子,那么维生素C发生了
(5)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和
(6)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式
您最近一年使用:0次
2017-06-18更新
|
281次组卷
|
2卷引用:辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题



