1 . 某有机物的结构简式为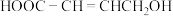 。
。
(1)该有机物所含官能团有羟基、___________ 和___________ (填名称)。
(2)该有机物能与溴的四氯化碳溶液发生反应生成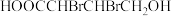 ,该反应属于
,该反应属于___________ (填“加成”或“取代”)反应。
(3)向该有机物溶液中滴入2~3滴紫色石蕊试液,溶液颜色变红,说明该有机物溶液具有___________ 性。
(4)为探究该有机物具有还原性,某学生向试管中加入3mL该有机物,将下端绕成螺旋状的铜丝在酒精灯火焰上方灼烧至红热后,迅速插入该有机物中,实验现象为___________ 。
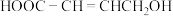 。
。(1)该有机物所含官能团有羟基、
(2)该有机物能与溴的四氯化碳溶液发生反应生成
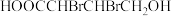 ,该反应属于
,该反应属于(3)向该有机物溶液中滴入2~3滴紫色石蕊试液,溶液颜色变红,说明该有机物溶液具有
(4)为探究该有机物具有还原性,某学生向试管中加入3mL该有机物,将下端绕成螺旋状的铜丝在酒精灯火焰上方灼烧至红热后,迅速插入该有机物中,实验现象为
您最近一年使用:0次
名校
解题方法
2 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

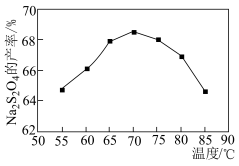
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
②二价锌在水溶液中的存在形式与pH的关系如图所示。
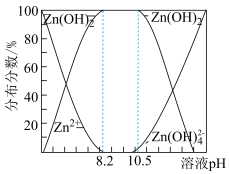
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
347次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
3 . 交警用经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)检查司机呼出的气体:2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,根据颜色的变化(橙黄变灰绿),可以判断司机是否酒后驾车。下列有关说法正确的是
| A.Cr3+价电子排布式为3d24s1 |
B.SO 空间结构为正四面体形 空间结构为正四面体形 |
| C.CH3COOH中碳原子杂化类型为sp杂化 |
D.基态硫原子核外价电子的轨道表示式为 |
您最近一年使用:0次
4 . 我国科学家首次在实验室实现从CO2到淀粉的全合成。其部分合成路线如图所示:
CO2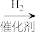 CH3OH
CH3OH HCHO
HCHO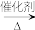 …→(C6H10O5)n
…→(C6H10O5)n
(1)CH3OH分子中与氧原子形成共价键的原子为_______ 。
(2)CH3CHO与HCHO互为同系物,具有相同的官能团是_______ (写名称)。
(3)CO2催化加H2制CH3OH,该反应一般由以下两步反应实现:
Ⅰ. CO2+H2⇌CO+H2O Ⅱ. ……
写出一定条件下反应Ⅱ的化学方程式:_______ 。
CO2
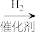 CH3OH
CH3OH HCHO
HCHO …→(C6H10O5)n
…→(C6H10O5)n(1)CH3OH分子中与氧原子形成共价键的原子为
(2)CH3CHO与HCHO互为同系物,具有相同的官能团是
(3)CO2催化加H2制CH3OH,该反应一般由以下两步反应实现:
Ⅰ. CO2+H2⇌CO+H2O Ⅱ. ……
写出一定条件下反应Ⅱ的化学方程式:
您最近一年使用:0次
5 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近一年使用:0次
2024-01-12更新
|
211次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
名校
解题方法
6 . 燃料电池是一种具有广阔发展前景的化学电源,与一般电池的主要区别在于燃料电池的活性物质是在工作时不断从外部输入的。某氢氧燃料电池的工作原理如图所示,下列说法不正确的是
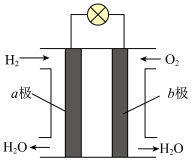

| A.该装置将化学能转化为电能 |
B.通入 的a极为正极 的a极为正极 |
| C.该电池工作时电子的流动方向:a极→b极 |
| D.该电池是一种具有优异应用前景的绿色电源 |
您最近一年使用:0次
2024-01-12更新
|
421次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
名校
解题方法
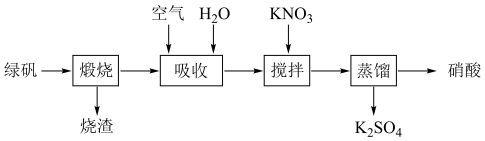
7 . 我国在明代就有了利用绿矾(FeSO4·7H2O)和硝酸钾制备硝酸的工艺,其主要流程如下:_______ 。
(2)“吸收”过程通入足量空气的目的是_______ 。
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有_______ (用化学式表示)。
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。___
(2)“吸收”过程通入足量空气的目的是
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。
已知:8H++MnO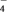 +5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
+5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
您最近一年使用:0次
2024-01-10更新
|
127次组卷
|
3卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题
名校
解题方法
8 . 实验室制备CuCl:将按一定物质的量之比混合的CuSO4溶液和NaCl溶液加入到三颈烧瓶中(装置如图1所示,其中夹持仪器已省略),通入SO2,充分反应后过滤,得CuCl。CuCl的产率随NaCl和CuSO4的物质的量之比变化如图2所示。已知:CuCl是难溶于水的白色固体,能溶于浓盐酸产生[CuCl2]-。下列说法错误的是

| A.装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2 |
| B.装置b的作用是安全瓶,防止倒吸 |
| C.装置c中的液体可以是NaOH浓溶液,吸收尾气 |
| D.当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]- |
您最近一年使用:0次
2024-01-10更新
|
192次组卷
|
3卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题
名校
解题方法
9 . 氨是工业制取硝酸的原料,制备硝酸时利用了氨的性质是
| A.无色无味气体 | B.极易溶于水 |
| C.具有还原性 | D.氨气易液化 |
您最近一年使用:0次
2024-01-10更新
|
150次组卷
|
2卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题
10 . 盐城:西周前为“淮夷”地;汉武始建盐渎县;东晋因“环城皆盐场”更名为盐城。这里的“盐”中除NaCl外,还有 、
、 等。下列关于
等。下列关于 的分类不正确的是
的分类不正确的是
 、
、 等。下列关于
等。下列关于 的分类不正确的是
的分类不正确的是| A.化合物 | B.镁盐 | C.氧化物 | D.硫酸盐 |
您最近一年使用:0次



