解题方法
1 . 如图是某化肥厂在一公共场所的围墙上的广告:

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由___________ 种元素组成的。
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是___________ (填“真实”或“虚假”)广告,判断的依据是___________ 。
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意___________ 。

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意
您最近一年使用:0次
22-23高二下·全国·课时练习
解题方法
2 . 三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子中原子个数比N(C)∶N(H)∶N(N)=_______ 。
(2)三聚氰胺的分子式为_______ 。
(3)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为_______ 。
(1)分子中原子个数比N(C)∶N(H)∶N(N)=
(2)三聚氰胺的分子式为
(3)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
名校
解题方法
3 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制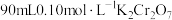 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 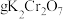 固体(
固体(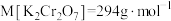 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6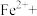 1
1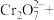 □
□ =□
=□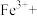 □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
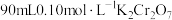 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
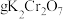 固体(
固体(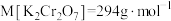 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
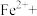 1
1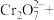 □
□ =□
=□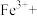 □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
2022-01-19更新
|
462次组卷
|
5卷引用:研究与实践2 检验食品中的铁元素
解题方法
4 . 阅读并分析体检报告,可以初步判断体检者的身体状况。
(1)在图中所示的体检报告中,表示葡萄糖指标的物理量是___________ (填字母)。
a.质量分数 b.溶解度 c.摩尔质量 d.物质的量浓度
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的?___________
(3)检测人的血液中葡萄糖(简称血糖,葡萄糖的相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值为3.9~6.1mmol/L。如果以“mg/dL”表示,血糖正常值范围是___________ ?若某人的血糖检测结果为92mg/dL,他(她)的血糖正常吗?___________
(1)在图中所示的体检报告中,表示葡萄糖指标的物理量是
序号 | 项目名称 | 英文缩写 | 检查结果 | 单位 | 参考范围 |
12 | *钾 | K | 4.1 | mmol/L | 3.5-5.5 |
13 | *钠 | Na | 140 | mmol/L | 135-145 |
14 | *氯 | Cl | 103 | mmol/L | 96-111 |
15 | 钙 | Ca | 0.68 | mmol/L | 2.13-2.70 |
16 | 胱抑素 | CyaC | 0.78 | mg/L | 0.59-1.03 |
18 | *尿素 | Urea | 4.18 | mmol/L | 2.78-7.14 |
19 | *葡萄糖 | Glu | 5.1 | mmol/L | 3.9-6.1 |
21 | *无机磷 | P | 1.19 | mmol/L | 0.81-1.45 |
22 | *总胆固醇 | TC | 4.65 | mmol/L | 2.85-5.70 |
23 | *甘油三酯 | TG | 1.50 | mmol/L | 0.45-1.70 |
24 | 高密度脂蛋白胆固醇 | HDL-V | 1.08 | mmol/L | 0.93-1.83 |
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的?
(3)检测人的血液中葡萄糖(简称血糖,葡萄糖的相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值为3.9~6.1mmol/L。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
名校
5 . 液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险。为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为: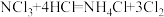 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(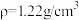 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。
(1)计算上述NaOH溶液的质量分数______ 。
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全______ ?
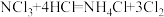 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(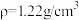 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。(1)计算上述NaOH溶液的质量分数
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全
您最近一年使用:0次
2021-11-18更新
|
128次组卷
|
2卷引用:作业(八) 物质的量在化学反应中的应用
21-22高一上·全国·课时练习
6 . 如图为各元素在地壳中含量的质量分数:

问题:金属元素在地壳中的含量远小于非金属元素,结合初中化学所学,概括金属的物理性质和化学性质。___________

问题:金属元素在地壳中的含量远小于非金属元素,结合初中化学所学,概括金属的物理性质和化学性质。
您最近一年使用:0次
名校
7 . 某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下。

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol/L计算)如表所示。
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,溶解度均随温度的升高而增大,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和___________ 。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为___________ 。
(3)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续调节pH以得到绿色沉淀。
①调节pH约为6的原因是___________ 。
②试剂X可以是___________ (填字母)。
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)反应都需要在冰浴环境下进行,其作用除了可以减少氨水的挥发,还有______ 。步骤(d)发生的总反应化学方程式为________ 。
(5)NH3含量的测定
用电子天平称量mg产品于锥形瓶中,用25mL水溶解后,加入3.00mL6mol/L盐酸(此时溶液中镍元素只以Ni2+形式存在)。滴加2滴甲基橙作为指示剂,滴定至终点消耗0.5000mol·L-1NaOH标准溶液VmL;
①达到滴定终点的现象是:___________ 。
②该产品中NH3的质量分数为___________ 。
③在上述方案的基础上,下列措施能进一步提高测定准确度的有___________ (填字母)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(6)为测定Cl的含量,设计了如下实验方案,请将该方案补充完整:
称量mg产品于锥形瓶中,用25mL水将产品完全溶解,___________ ,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol/L计算)如表所示。
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,溶解度均随温度的升高而增大,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为
(3)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续调节pH以得到绿色沉淀。
①调节pH约为6的原因是
②试剂X可以是
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)反应都需要在冰浴环境下进行,其作用除了可以减少氨水的挥发,还有
(5)NH3含量的测定
用电子天平称量mg产品于锥形瓶中,用25mL水溶解后,加入3.00mL6mol/L盐酸(此时溶液中镍元素只以Ni2+形式存在)。滴加2滴甲基橙作为指示剂,滴定至终点消耗0.5000mol·L-1NaOH标准溶液VmL;
①达到滴定终点的现象是:
②该产品中NH3的质量分数为
③在上述方案的基础上,下列措施能进一步提高测定准确度的有
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(6)为测定Cl的含量,设计了如下实验方案,请将该方案补充完整:
称量mg产品于锥形瓶中,用25mL水将产品完全溶解,
您最近一年使用:0次
8 . 欲测定某铁铝合金的含量,将样品溶于盐酸,然后加入足量的烧碱溶液,待沉淀全部转化为红褐色时过滤,并将沉淀灼烧,最后得到红棕色粉末,经称量恰好与原合金的质量相等,则合金中铁的质量分数是
| A.30% | B.50% | C.70% | D.85% |
您最近一年使用:0次
真题
名校
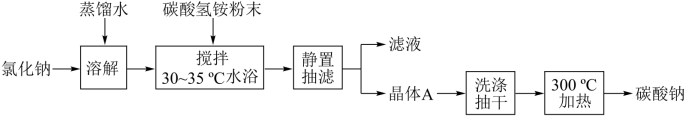
9 . 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
的制备
步骤Ⅱ.产品中 含量测定
含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸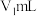 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
④平行测定三次, 平均值为22.45,
平均值为22.45,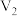 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表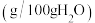
回答下列问题:
(1)步骤I中晶体A的化学式为_______ ,晶体A能够析出的原因是_______ ;
(2)步骤I中“300℃加热”所选用的仪器是_______ (填标号);
A. B.
B.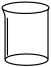 C.
C.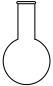 D.
D.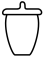
(3)指示剂N为_______ ,描述第二滴定终点前后颜色变化_______ ;
(4)产品中 的质量分数为
的质量分数为_______ (保留三位有效数字);
(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果_______ (填“偏大”“偏小”或“无影响”)。
步骤I.
 的制备
的制备
步骤Ⅱ.产品中
 含量测定
含量测定①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸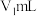 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;④平行测定三次,
 平均值为22.45,
平均值为22.45,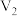 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表
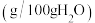
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(1)步骤I中晶体A的化学式为
(2)步骤I中“300℃加热”所选用的仪器是
A.
 B.
B. C.
C. D.
D.
(3)指示剂N为
(4)产品中
 的质量分数为
的质量分数为(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
2021-06-09更新
|
9124次组卷
|
31卷引用:第三章 综合拔高练
第三章 综合拔高练2021年新高考湖南化学高考真题(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第6讲 钠及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省新余市第一中学2021-2022学年高三上学期第二次模拟考试化学试题2021年湖南省高考化学试卷变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第06讲 钠及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省常德市汉寿县第一中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题辽宁省葫芦岛市兴城市高级中学等四校2022-2023学年高二上学期12月月考化学试题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破山东省济南市历城第二中学2022-2023学年高二上学期期末线上测试化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第十章 化学综合实验 第64讲 物质的检测综合实验探究热点1滴定法(已下线)第一部分 化学综合实验 综合提能训练(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 测定冶金级高纯硅中铁元素的含量:将mg样品用氢氟酸和硝酸溶解处理,配成V mL溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入邻二氮菲,形成橙红色物质。利用吸光度法测得吸光度为0.500(吸光度与Fe2+浓度的关系曲线如图所示)。
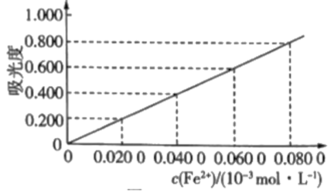
(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数表达式为___________ (用字母表示)。

(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为
(2)样品中铁元素的质量分数表达式为
您最近一年使用:0次



