1 . 不同元素的第一电离能 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
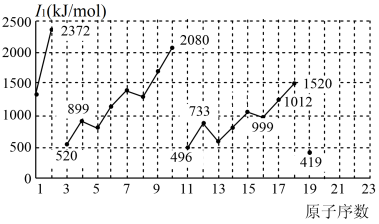
(1)总结同主族内不同元素的 变化的特点
变化的特点______ 。
(2)同周期内,随原子序数增大, 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是_______ (填序号)。
① (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)
③ (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)
(3)解释10号元素 较大的原因
较大的原因______ 。
(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围______ 。
 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)总结同主族内不同元素的
 变化的特点
变化的特点(2)同周期内,随原子序数增大,
 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是①
 (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)③
 (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)(3)解释10号元素
 较大的原因
较大的原因(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围
您最近一年使用:0次
2 . 请概括元素的原子结构与元素在元素周期表中位置的关系。______
您最近一年使用:0次
20-21高一·全国·课时练习
3 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分, 回答下列问题:
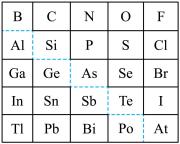
(1)元素Ga在元素周期表中的位置为:_______ ;
(2)Sn的最高正价为_______ ,Cl的最高价氧化物对应水化物的化学式为_______ ;
(3)根据元素周期律,推断
①阴影部分元素形成的氢化物中热稳定性最高的是_______ ;(写化学式)
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4_______ H2SeO4 (填“>”、“<”、“=”或“无法比较”);
③氢化物的还原性:H2O_______ H2S (填“>”、“<”、“=”或“无法比较”);
④原子半径比较:N_______ Si (填“>”、“<”、“=”或“无法比较”)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断
①阴影部分元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
您最近一年使用:0次
2021-09-17更新
|
1205次组卷
|
5卷引用:人教必修第一册第4章第1节第4课时原子结构与元素的性质(课后)
(已下线)人教必修第一册第4章第1节第4课时原子结构与元素的性质(课后)(已下线)5.1.2 元素周期表 元素周期表的应用-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)湖北省荆州市八县市2021-2022学年高一上学期期末质量检测化学试题(已下线)第四章 物质结构 元素周期律(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练
4 . X、Y、Z、M、Q、R是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如表所示:
请回答下列问题。
(1)请写出元素Q的基态原子的价电子轨道表示式:______ 。
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是______ (用元素符号表示)。
(3)元素R可形成 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是______ 。
(4)短周期元素T与元素M在周期表中的位置呈现对角线关系,则元素T为______ (填元素符号);已知元素T、Q的电负性分别为1.5和3.0,则它们形成的化合物是______ (填“离子化合物”或“共价化合物”)。
| 元素代号 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 第一至第六电离能( )依次为578、1817、2745、11575、14830、18376 )依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级上有电子且能量最高的能级上有6个电子 |
(1)请写出元素Q的基态原子的价电子轨道表示式:
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(3)元素R可形成
 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)短周期元素T与元素M在周期表中的位置呈现对角线关系,则元素T为
您最近一年使用:0次
5 . 如图表示元素周期表中部分元素的某种性质(X值)随原子序数变化的关系示意图。______ (填元素符号)。
(2)同主族内不同元素的X值变化的特点是______ ;同周期内,随着原子序数的增大,X值的变化总趋势是______ 。元素周期表中X值的这种变化特点体现了元素性质的______ 变化规律。
(3)预测S元素与 元素x值的大小关系为
元素x值的大小关系为______ ,x值最小的元素在元素周期表中的位置是______ (放射性元素除外)。
(4)X值较小的元素集中在元素周期表的______ (填标号)。
a.左下角 b.右上角 c.分界线附近
(5)下列关于元素性质的说法正确的是______ (填标号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
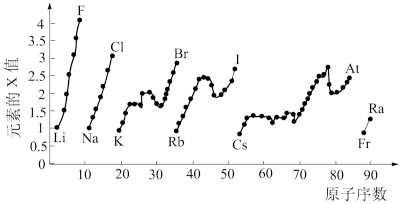
(2)同主族内不同元素的X值变化的特点是
(3)预测S元素与
 元素x值的大小关系为
元素x值的大小关系为(4)X值较小的元素集中在元素周期表的
a.左下角 b.右上角 c.分界线附近
(5)下列关于元素性质的说法正确的是
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
您最近一年使用:0次
2021-02-15更新
|
239次组卷
|
2卷引用:(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷
解题方法
6 . W、X、Y、Z为原子序数依次增大的短周期主族元素,W2-与Ne原子的电子层结构相同,W、X、Y在元素周期表中的相对位置如图。下列有关叙述中正确的是
| W | |||
| X | Y |
| A.W、Y形成的化合物溶于水得到的一定是强酸 |
B.元素X、Y、Z形成的简单离子半径关系: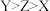 |
| C.含元素Z的化合物都具有漂白性 |
| D.W、X形成的化合物易溶于水 |
您最近一年使用:0次
7 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于____ 区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素的中文名称,分别为“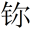 (nǐ)”“镆(mò)”“
(nǐ)”“镆(mò)”“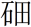 (tián)”“
(tián)”“ (ào)”,则下列说法正确的是
(ào)”,则下列说法正确的是___ (填字母序号)。
a.115号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的___ ,该元素M能层上具有____ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D___ E(填“>”“<”或“=”)。
②气态氢化物的沸点:B___ F(填“>”“<”或“=”),理由是___ 。
(1)认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素的中文名称,分别为“
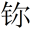 (nǐ)”“镆(mò)”“
(nǐ)”“镆(mò)”“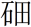 (tián)”“
(tián)”“ (ào)”,则下列说法正确的是
(ào)”,则下列说法正确的是a.115号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
8 . 回答下列问题:
(1)锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物的叙述不正确的是___ 。
A.Li2SO4难溶于水
B.Li与N2反应产物是Li3N
C.LiOH难溶于水
D.LiOH与Li2CO3受热都易分解
(2)与铝位于对角线位置的第二周期元素是Be,能区别Be(OH)2和Mg(OH)2的一种试剂是___ ,反应的离子方程式为___ 。
(3)门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下空位。例如,他预测在铝的下方有一个与铝类似的元素“类铝”,后来被法国化学家于1875年发现,命名为镓。它在周期表中的位置是___ 。
(4)关于与镓同主族的第六周期元素性质的推测中不正确的是___ 。
A.单质是银白色较软的金属
B.其氢氧化物是两性氢氧化物
C.在化合物中显+3价
D.单质与盐酸的反应比铝剧烈
(5)写出短周期主族元素中原子半径最大的原子的单质在空气中加热条件下反应产物的电子式___ 。
(1)锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物的叙述不正确的是
A.Li2SO4难溶于水
B.Li与N2反应产物是Li3N
C.LiOH难溶于水
D.LiOH与Li2CO3受热都易分解
(2)与铝位于对角线位置的第二周期元素是Be,能区别Be(OH)2和Mg(OH)2的一种试剂是
(3)门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下空位。例如,他预测在铝的下方有一个与铝类似的元素“类铝”,后来被法国化学家于1875年发现,命名为镓。它在周期表中的位置是
(4)关于与镓同主族的第六周期元素性质的推测中不正确的是
A.单质是银白色较软的金属
B.其氢氧化物是两性氢氧化物
C.在化合物中显+3价
D.单质与盐酸的反应比铝剧烈
(5)写出短周期主族元素中原子半径最大的原子的单质在空气中加热条件下反应产物的电子式
您最近一年使用:0次
解题方法
9 . 如图是原子序数为1~19的元素第一电离能的变化曲线(其中部分元素第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题。
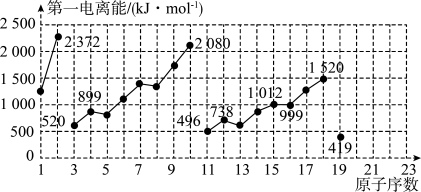
(1)碱金属元素中Li、Na、K的第一电离能分别为_____________  、
、 _____________  、
、 _____________  。
。
(2)同主族中不同元素的第一电离能变化的规律为:_____________ ,碱金属元素这一变化的规律与碱金属的活泼性的关系是 _____________ 。
(3)钙元素的第一电离能的数值范围为_____________ 。

(1)碱金属元素中Li、Na、K的第一电离能分别为
 、
、  、
、  。
。(2)同主族中不同元素的第一电离能变化的规律为:
(3)钙元素的第一电离能的数值范围为
您最近一年使用:0次
解题方法
10 . 元素周期律和元素周期表对深入认识物质的性质具有重要的作用,有利于将零散的元素及其化合物的知识整合起来形成知识网络。通过本章的学习,你是否对学习过的元素及其化合物的知识进行了整合?请尝试用图示的方式进行总结,并与同学们交流分享,示例如下:
李明打开元素周期表,看到元素符号“N”,便按照以下思路回顾和整理了关于氮元素的相关知识。
(1)氮元素的原子结构示意图_____ 、元素符号_____ 。
(2)氮元素所在周期的元素性质递变规律_____ 。
(3)氮元素所在主族的元素性质递变规律_____ 。
(4)含有氮元素的常见物质的性质及它们之间的转化关系_____ 。
李明打开元素周期表,看到元素符号“N”,便按照以下思路回顾和整理了关于氮元素的相关知识。
(1)氮元素的原子结构示意图
(2)氮元素所在周期的元素性质递变规律
(3)氮元素所在主族的元素性质递变规律
(4)含有氮元素的常见物质的性质及它们之间的转化关系
您最近一年使用:0次



