1 . 现有一种由正离子An+、Bm+和负离子X—组成的无机固体电解质,该物质在高温相为无序结构,低温相为有序结构,两者的结构如图,下列说法错误的是
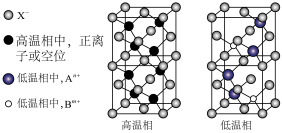
| A.n=2,m=1 | B.高温相中X—的堆积方式和氯化钠中Cl—的堆积方式相同 |
| C.低温相中An+的配位数为4 | D.高温相的良好导电性与其结构中存在大量的空位有关 |
您最近一年使用:0次
2024-04-13更新
|
753次组卷
|
4卷引用:第三章晶体结构与性质(B卷)
2 . 湿法冶炼是以赤铜矿(Cu2O)精矿为主要原料,通过浸出、置换、电解等流程制备高纯度铜的工艺。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为_______ 个。

(2)计算Cu2O晶体的密度ρ=_______ g/cm3.(结果保留两位小数)
(3)测定晶体结构最常用的仪器为
(4)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为_______ 。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为

(2)计算Cu2O晶体的密度ρ=
(3)测定晶体结构最常用的仪器为
| A.质谱仪 | B.核磁共振仪 | C.红外光谱仪 | D.X射线衍射仪 |
您最近一年使用:0次
3 . 层状半导体材料 (二硫化钼)的结构与石墨结构相似,由此推知,
(二硫化钼)的结构与石墨结构相似,由此推知, 晶体最可能是
晶体最可能是
 (二硫化钼)的结构与石墨结构相似,由此推知,
(二硫化钼)的结构与石墨结构相似,由此推知, 晶体最可能是
晶体最可能是| A.离子晶体 | B.金属晶体 | C.混合型晶体 | D.分子晶体 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(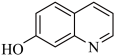 )、6−羟基喹啉(
)、6−羟基喹啉(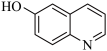 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
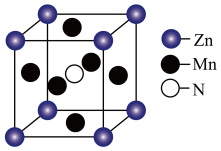
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
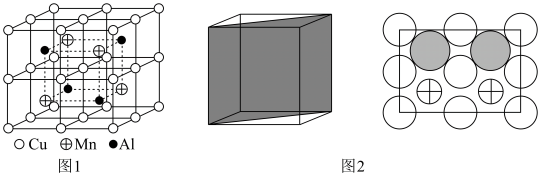
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
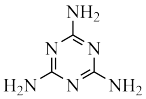
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.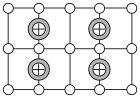 | B.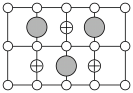 |
C. | D.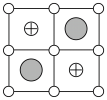 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
5 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的______ 区。
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有______ (填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为______ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有______ ,如表是2种二烃基锌的沸点数据,则烃基R1是______ ,推断的依据,是______ 。
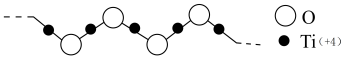
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为______ 。______ g•cm-3。用Al掺杂TiN后,其晶胞结构如图所示,距离Ti最近的Al有______ 个。(NA为阿伏加德罗常数的值)。
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(℃) | 46 | 118 |
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为

您最近一年使用:0次
解题方法
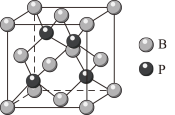
6 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(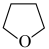 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: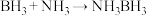 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: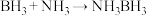 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
7 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
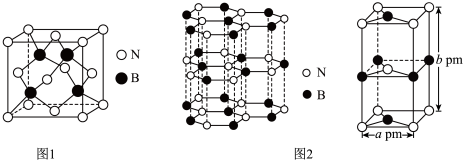
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为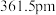 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为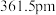 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
451次组卷
|
3卷引用:第三章晶体结构与性质(B卷)
解题方法
8 . 下列有关物质结构与性质的说法错误的是
| A.键角:PH3>NH3 | B.离子键成分的百分数:Ca3N2>Mg3N2 |
| C.原子半径:Be>B | D.电离常数 :三氟乙酸>三氯乙酸 :三氟乙酸>三氯乙酸 |
您最近一年使用:0次
9 . 完成下列问题。
(1)酶是生物体中产生的具有催化作用的蛋白质,其催化作用具有_______ 、_______ 、_______ 等特点。
(2)核酸是一类含_______ 的生物高分子化合物,在生物体的生长、繁殖、_______ 、_______ 等生命现象中起着决定性作用,核酸分为DNA和RNA。DNA主要存在于_______ 中,其主要功能是_______ ;RNA主要存在于_______ 中,其主要功能是_______ 。
(1)酶是生物体中产生的具有催化作用的蛋白质,其催化作用具有
(2)核酸是一类含
您最近一年使用:0次
名校
10 . 高分子材料在各个领域中得到广泛应用.下列说法错误的是
| A.2022年世界杯官方用球“旅程”由聚氨酯材料通过热黏合组合而成,该聚氨酯分子为线型结构 |
| B.用于生产尿不湿的高吸水性树脂属于功能高分子材料 |
| C.神舟返回舱逃逸系统复合材料中的酚醛树脂可通过加聚反应合成 |
| D.核苷酸通过缩聚反应可以得到核酸,核酸属于生物大分子 |
您最近一年使用:0次
2024-03-27更新
|
375次组卷
|
5卷引用:第五章 合成高分子(B卷)
(已下线)第五章 合成高分子(B卷) 河北省保定市部分高中2023-2024学年高三下学期开学化学试题河北省石家庄市河北正定中学2023-2024年高三下学期3月开学考试化学试题河北省强基名校联盟2023-2024学年高三下学期开学联考化学试题(已下线)选择题1-5



