名校
1 . 下表是元素周期表的一部分,a~k分别代表10种元素,请回答:
(1)元素a~k中,其简单氢化物最稳定的是_____ (填元素符号)。
(2)b的简单氢化物的结构式_____ 。
(3)c、d、e、f中形成的简单离子半径由大到小的顺序是_____ (填离子符号)。
(4)写出两种由c原子和e原子构成的化合物的电子式_____ 。
(5)元素h、i的最高价氧化物对应水化物中酸性较强的是_____ (填化学式)。
(6)写出84号元素在元素周期表中的位置_____ 。
(7)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是_____ 。
(8)下列说法能证明金属性k强于f的是_____ (填序号)。
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
| a | ||||||||
| b | c | d | ||||||
| e | f | g | h | i | ||||
| k | …… | |||||||
(2)b的简单氢化物的结构式
(3)c、d、e、f中形成的简单离子半径由大到小的顺序是
(4)写出两种由c原子和e原子构成的化合物的电子式
(5)元素h、i的最高价氧化物对应水化物中酸性较强的是
(6)写出84号元素在元素周期表中的位置
(7)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是
(8)下列说法能证明金属性k强于f的是
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
您最近一年使用:0次
名校
解题方法
2 . 判断正误,错误的说明原因_______ 。
| 说法 | 判断 | 错误的说明原因 |
| Na2CO3溶于水伴随放热现象,NaHCO3溶于水伴随吸热现象 | _______ | _______ |
| CaO与水反应生成碱,Na2O与水反应也生成碱 | _______ | _______ |
| Na与Cl之间形成离子键,Al与Cl之间也形成离子键 | _______ | _______ |
| 常温常压下,46gNO2和N2O4混合气体中含有的原子总数为3NA | _______ | _______ |
| 7.1gCl2与H2O反应转移电子数为0.1NA | _______ | _______ |
| 0.1molH2O2中极性共价键数目为0.3NA | _______ | _______ |
| Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱 | _______ | _______ |
| Na2S+Br2=2NaBr+S,足以证明非金属性Br>S氧化性 | _______ | _______ |
| 1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强 | _______ | _______ |
| SiO2由固态转化为液态需要克服分子间作用力 | _______ | _______ |
您最近一年使用:0次
名校
3 . 在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是


| A.熔点比较:C60<C70<C90<金刚石 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石不如石墨稳定 |
| C.C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个(每个小球表示一个C60分子) |
| D.金刚石、C60、C70互为同位素 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法中,正确的是
A.取溴乙烷加入 溶液,加热,充分反应,再加入 溶液,加热,充分反应,再加入 溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素 溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素 |
| B.实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下 |
C.溴乙烷和 醇溶液共热,产生的气体通入酸性 醇溶液共热,产生的气体通入酸性 溶液,发现溶液褪色,证明溴乙烷发生了消去反应 溶液,发现溶液褪色,证明溴乙烷发生了消去反应 |
D.制备新制 悬浊液时,将4~6滴 悬浊液时,将4~6滴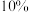 的 的 溶液滴入 溶液滴入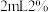 的 的 溶液中,边滴边振荡 溶液中,边滴边振荡 |
您最近一年使用:0次
2022-05-02更新
|
323次组卷
|
11卷引用:河北省沧州市盐山县盐山中学2019-2020学年高二下学期开学考试化学试题
河北省沧州市盐山县盐山中学2019-2020学年高二下学期开学考试化学试题河北省唐山市曹妃甸第一中学2020-2021学年高二下学期3月月考化学试题北京市西城区2017-2018学年高二下学期期末考试化学试题【全国百强校】云南省云天化中学2018-2019学年高二上学期期中考试化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高二下学期期中考试化学试题2019年秋高三化学复习强化练习——有机实验制备选择题甘肃省武威市民勤县第一中学2019-2020学年高二下学期第二次月考化学(理)试题广东省汕头市金山中学2020-2021学年高二上学期期中考试化学试题北京市第八中学2021-2022学年高二下学期期中考试化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期5月月考化学试题
5 . 某化学兴趣小组设计了如下实验装置证明乙醇与Na反应产生氢气。已知:乙醇能与无水CaCl2反应生成配合物CaCl2·xCH3CH2OH。下列说法中不正确的是
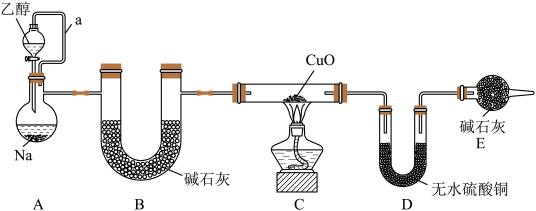
| A.a的作用是平衡气压,使乙醇液体顺利滴下 |
| B.若装置C中黑色粉末变红,D中白色粉末变蓝,即可证明乙醇与Na反应生成了氢气 |
| C.装置E的作用是防止空气中的水蒸气进入装置D中 |
| D.若将装置B中的碱石灰换成无水CaCl2,更合理 |
您最近一年使用:0次
2022-07-12更新
|
309次组卷
|
7卷引用:河北师范大学附属中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
6 . 下列叙述正确的是
①A和B是元素周期表中同主族金属元素,且A在B的下方,则A肯定比B的金属性强
②1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强
③Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱
④H2S比HBr的酸性弱,证明Br比S的非金属性强
⑤Na2S+Br2=2NaBr+S,足以证明非金属性Br>S
①A和B是元素周期表中同主族金属元素,且A在B的下方,则A肯定比B的金属性强
②1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强
③Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱
④H2S比HBr的酸性弱,证明Br比S的非金属性强
⑤Na2S+Br2=2NaBr+S,足以证明非金属性Br>S
| A.①③④ | B.①⑤ | C.②③⑤ | D.②③④ |
您最近一年使用:0次
名校
解题方法
7 . 通过下列实验装置及试剂,不能达到相应实验目的的是


| A.利用装置甲验证石蜡油裂解产生不饱和烃 |
B.利用装置乙测定 溶液的浓度 溶液的浓度 |
| C.利用装置丙证明铁在中性条件下发生吸氧腐蚀 |
| D.利用装置丁制备碳酸氢钠 |
您最近一年使用:0次
名校
8 . 探究是培养创新精神和实践能力的手段。
I.某无色溶液中可能含有 ,
, 、
、 ,
, ,
, ,
, ,
, 、
、 中的一种或几种,为确定其成分进行如下实验:
中的一种或几种,为确定其成分进行如下实验:
①取少量溶液,滴加无色酚酞试液,酚酞变红;
②另取少量溶液,加入足量 溶液,产生白色沉淀;
溶液,产生白色沉淀;
③向②所得混合物中加足量盐酸,沉淀全部溶解,并有无色气体生成;
④将③所得混合物过滤,向滤液中加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
(1)不做任何实验就可以判断该溶液中一定不含有的离子是___________ 。
(2)根据上述实验推断,原溶液中一定含有的离子是___________ ,可能含有的离子是___________ 。
II.用如下装置探究氯气的性质,图中3支试管口均放置浸有NaOH溶液的棉花。

(3)盛装浓盐酸的仪器名称是___________ ;①中发生反应的化学方程式是___________ 。
(4)观察到___________ 现象,可以证明Cl的非金属性强于I。
(5)②中产生白色沉淀,说明氯气与水反应生成 ,这种说法是否正确,并说明理由
,这种说法是否正确,并说明理由___________ 。
(6)③中溶液变黄,可证明 具有
具有___________ 性。
I.某无色溶液中可能含有
 ,
, 、
、 ,
, ,
, ,
, ,
, 、
、 中的一种或几种,为确定其成分进行如下实验:
中的一种或几种,为确定其成分进行如下实验:①取少量溶液,滴加无色酚酞试液,酚酞变红;
②另取少量溶液,加入足量
 溶液,产生白色沉淀;
溶液,产生白色沉淀;③向②所得混合物中加足量盐酸,沉淀全部溶解,并有无色气体生成;
④将③所得混合物过滤,向滤液中加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。(1)不做任何实验就可以判断该溶液中一定不含有的离子是
(2)根据上述实验推断,原溶液中一定含有的离子是
II.用如下装置探究氯气的性质,图中3支试管口均放置浸有NaOH溶液的棉花。

(3)盛装浓盐酸的仪器名称是
(4)观察到
(5)②中产生白色沉淀,说明氯气与水反应生成
 ,这种说法是否正确,并说明理由
,这种说法是否正确,并说明理由(6)③中溶液变黄,可证明
 具有
具有
您最近一年使用:0次
名校
解题方法
9 . 下列装置可用于相应实验的是
|
|
|
|
| 图1 | 图2 | 图3 | 图4 |
A.用图1装置证明 与水反应放热 与水反应放热 |
B.用图2装置制备 固体时,b口通入 固体时,b口通入 ,a口通入 ,a口通入 |
| C.用图3装置除去铝粉中混有的铁粉 |
D.用图4装置可以比较非金属性: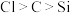 |
您最近一年使用:0次
2024-02-03更新
|
87次组卷
|
2卷引用:河北省石家庄市第二中学实验2023-2024学年高一下学期开学考试化学试题
10 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
学习小组在实验室中利用如图所示装置制备SO2并进行相关性质的探究。
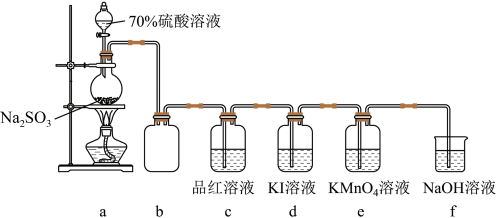
回答下列问题:
(1)实验用70%的硫酸而不用浓硫酸的原因是___________ 。
(2)装置e中出现___________ 填现象可证明SO2具有还原性,反应离子方程式为___________ 。
(3)实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+ S↓+2I2+2H2O。
S↓+2I2+2H2O。
探究:SO2在KI溶液体系中的反应产物
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO +2I-+4H+。
+2I-+4H+。
为进一步探究体系中的产物,完成下列实验方案。
综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为:___________ 。
(4)晶体碘酸钾(KIO3)是一种常用的食品添加剂,常用硫代硫酸钠滴定测定碘酸钾纯度:准确称取1.000gKIO3产品转移至200mL容量瓶中定容,精确量取20.00mL该溶液置于锥形瓶中,加入足量碘化钾,用5mL盐酸酸化(IO +5I−+6H+=3I2+3H2O),盖紧塞子,置于避光处3min,用0.1004mol/L硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点(I2+2S2O
+5I−+6H+=3I2+3H2O),盖紧塞子,置于避光处3min,用0.1004mol/L硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点(I2+2S2O =2I−+S4O
=2I−+S4O )。平行滴定三次,平均消耗0.1004mol/LNa2S2O3溶液的体积为25.00mL。
)。平行滴定三次,平均消耗0.1004mol/LNa2S2O3溶液的体积为25.00mL。
计算产品的纯度___________ 。(请写出计算过程,结果保留三位有效数字)。
学习小组在实验室中利用如图所示装置制备SO2并进行相关性质的探究。

回答下列问题:
(1)实验用70%的硫酸而不用浓硫酸的原因是
(2)装置e中出现
(3)实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:SO2+4I-+4H+
 S↓+2I2+2H2O。
S↓+2I2+2H2O。探究:SO2在KI溶液体系中的反应产物
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO
 +2I-+4H+。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
| 方案 | 操作 | 预期现象 | 结论 |
| ⅰ | 取适量装置d中浊液,向其中滴加几滴① | 无明显变化 | 浊液中无I2 |
| ⅱ | 将装置d中浊液进行分离 | 得淡黄色固体和澄清溶液 | |
| 取适量分离后的澄清溶液于试管中,② | ③ | ④ |
(4)晶体碘酸钾(KIO3)是一种常用的食品添加剂,常用硫代硫酸钠滴定测定碘酸钾纯度:准确称取1.000gKIO3产品转移至200mL容量瓶中定容,精确量取20.00mL该溶液置于锥形瓶中,加入足量碘化钾,用5mL盐酸酸化(IO
 +5I−+6H+=3I2+3H2O),盖紧塞子,置于避光处3min,用0.1004mol/L硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点(I2+2S2O
+5I−+6H+=3I2+3H2O),盖紧塞子,置于避光处3min,用0.1004mol/L硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点(I2+2S2O =2I−+S4O
=2I−+S4O )。平行滴定三次,平均消耗0.1004mol/LNa2S2O3溶液的体积为25.00mL。
)。平行滴定三次,平均消耗0.1004mol/LNa2S2O3溶液的体积为25.00mL。计算产品的纯度
您最近一年使用:0次
2024-03-01更新
|
466次组卷
|
2卷引用:河北省曲阳县第一高级中学2023-2024学年高一下学期开学考试化学试题







