名校
解题方法
1 . 如表是元素周期表的一部分,参照元素在表中的位置,回答下列问题:
(1)上述元素最高价氧化物对应水化物中,酸性最强的是__________ (填化学式),碱性最强的是__________ (填化学式),显两性的是__________ (填名称)。
(2)气态氢化物中,最稳定的是__________ (填化学式),④⑧形成的氢化物中沸点最高的是__________ (填化学式),原因是__________________ 。
(3)④分别和①、⑥两种元素的原子按1:1组成的常见化合物的电子式分别为__________ 和_______ 。用电子式表示②和④的三原子分子的形成过程____________ 。
(4)④⑥⑦⑨的简单离子半径由大到小的顺序为__________ (用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式___________ 。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
主族 周期 | IA | IIA | IIA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)气态氢化物中,最稳定的是
(3)④分别和①、⑥两种元素的原子按1:1组成的常见化合物的电子式分别为
(4)④⑥⑦⑨的简单离子半径由大到小的顺序为
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
名校
2 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b.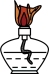 c.
c. d.
d.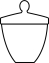
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
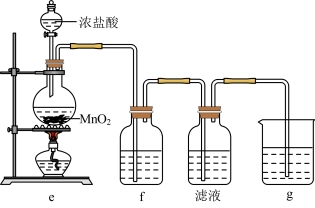
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是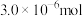 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是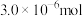 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
524次组卷
|
3卷引用:山西省大同市第二中学校2023届高三上学期开学考试化学试题
名校
3 . 某同学用以下装置制备并检验 的性质。下列说法正确的是
的性质。下列说法正确的是
 的性质。下列说法正确的是
的性质。下列说法正确的是
A.图Ⅰ:若 过量,则浓盐酸可全部消耗完 过量,则浓盐酸可全部消耗完 |
| B.图Ⅱ:只证明新制氯水具有酸性 |
| C.图Ⅲ:产生了棕黄色的雾 |
| D.图Ⅳ:湿润的有色布条褪色 |
您最近一年使用:0次
2022-11-19更新
|
1538次组卷
|
38卷引用:山西省运城市芮城中学2021-2022学年高一下学期开学摸底考试化学试题
山西省运城市芮城中学2021-2022学年高一下学期开学摸底考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期开学考试化学试题云南省镇沅县第一中学校2021-2022学年高一下学期开学考试化学试题【全国百强校】西藏日喀则市第一高级中学2017-2018学年高一下学期期中考试化学试题(已下线)2018年11月24日 《每日一题》人教必修1 -周末培优(已下线)【走进新高考】(人教版必修一)4.2.1富集在海水中的元素——氯(氯气) 同步练习02(已下线)2019年11月20日 《每日一题》高一化学人教版(必修1)——氯气的实验室制取河南省鹤壁市2018-2019学年高一上学期期末考试化学试题甘肃省武威市古浪县第二中学2020届高三上学期第四次诊断考试化学试题福建省莆田第二十五中学2019-2020学年高一上学期期末考试化学试题黑龙江省牡丹江市穆棱一中2019-2020学年高一上学期期末考试化学试题(已下线)第10讲 氯及其化合物-2021年高考化学一轮复习名师精讲练人教版(2019)高一必修第一册 第二章 第二节课时2 氯气的实验室制法及氯离子的检验高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物1黑龙江省哈尔滨师范大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)4.2.2 氯气与碱反应及Cl-的检验(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)【浙江新东方】高中化学20210304-016(已下线)【浙江新东方】高中化学20210304-015青海西宁市田家寨中学2020-2021学年高一下学期第一次月考化学试题(已下线)衔接点16 氯离子的检验方法和卤素的性质-2021年初升高化学无忧衔接(已下线)3.1.2 氯气的性质及应用(1)(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)天津市南开中学2021-2022学年高一上学期期中考试化学试题上海市黄浦区大同中学2021-2022学年高一上学期期中考试化学试题辽宁省昌图第一高级中学2021-2022学年高一上学期期中考试化学试题(已下线)衔接点17 氯离子的检验方法和卤素的性质-2022年初升高化学无忧衔接?浙江省东阳中学2021-2022学年高一上学期1月份考试化学试题安徽省滁州市定远县育才学校2021-2022学年高一上学期第三次月考化学试题安徽省滁州市定远县育才学校2021-2022学年高一上学期月考化学试题江苏省南京师范大学附属中学2021-2022学年高一上学期期末考试化学试题福建省泉州科技中学2021-2022学年高一上学期期中考试化学试题内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(职高部)化学试题湖南省株洲市南方中学2022-2023学年高一上学期期末考试化学试题(已下线)【精品卷】2.2.2 氯气的制法课堂例题-人教版2023-2024学年必修第一册吉林省吉林市第一中学2023--2024学年高一上学期第一次月考化学试题(创新班)河北省唐山市丰润区2023-2024学年高一上学期期中考试化学试题(已下线)专题04 氯气及氯的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)湖南省常德市第一中学2023-2024学年高一上学期期末考试化学试题
4 . 下列关于苯的叙述正确的是
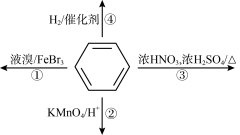

| A.反应①常温下不能进行,需要加热 |
| B.反应②不能发生,但是仍有分层现象,紫色层在下层 |
| C.反应③为加成反应,产物是一种烃的衍生物 |
| D.反应④能发生,从而证明苯中含有碳碳双键 |
您最近一年使用:0次
2022-04-10更新
|
355次组卷
|
21卷引用:山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题
山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题(已下线)2012-2013学年重庆一中高一下学期期末考试化学试卷2014-2015学年河北省邯郸市高一下学期期末考试化学试卷四川省三台中学2016-2017学年高一下学期第二次月考(5月)化学试题(已下线)2018年5月7日 苯的结构与性质——《每日一题》2017-2018学年高一化学人教必修2辽宁省本溪市第一中学2018-2019学年高二上学期期末考试化学试题河北省临漳县第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省大庆市第一中学2018-2019学年高一下学期第二次阶段考试化学试题(已下线)2019年4月29日 《每日一题》必修2-苯的结构与性质(已下线)【新东方】高中化学151(已下线)考点15 脂肪烃和芳香烃——《备战2020年高考精选考点专项突破题集》山东省德州市夏津第一中学2019-2020学年高一5月月考化学试题(已下线)【南昌新东方】2019-2020 南大附中 高一下 第三次月考河北省衡水市桃城区第十四中学2019-2020学年高一下学期第七次综合测试化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高二上学期第二次月考化学试题江西省宜春市铜鼓中学2020-2021学年高一下学期第一次月考化学(实验班)试题江苏省南京市第十二中学2021-2022学年高二下学期3月份学情调研化学试题吉林省吉林市第一中学2021-2022学年高二下学期第一次月考化学试题辽宁省建平县实验中学2021-2022学年高二下学期第三次月考化学试题(已下线)第50练 芳香烃-2023年高考化学一轮复习小题多维练(全国通用) 吉林省吉林市第十二中学2021-2022学年高二下学期第一次月考化学试题
名校
5 .  是大气污染物之一,但也是重要的化工原料。回答下列问题:
是大气污染物之一,但也是重要的化工原料。回答下列问题:
(1)工业生产向大气中排放含有 的尾气是形成酸雨的原因之一。酸雨的危害巨大,因此工业尾气排放前必须进行净化处理。
的尾气是形成酸雨的原因之一。酸雨的危害巨大,因此工业尾气排放前必须进行净化处理。
①下列物质可以用来吸收尾气中 的是
的是_______ (填字母)。
a. 溶液 b.饱和
溶液 b.饱和 溶液
溶液
c. 溶液 d.饱和
溶液 d.饱和 溶液
溶液
②以生石灰为脱硫剂,与尾气中 反应将硫固定,其产物可作建筑材料。写出该反应的化学方程式:
反应将硫固定,其产物可作建筑材料。写出该反应的化学方程式:_______ 。
(2)某化学兴趣小组为探究 的性质,设计如图所示装置进行实验。
的性质,设计如图所示装置进行实验。
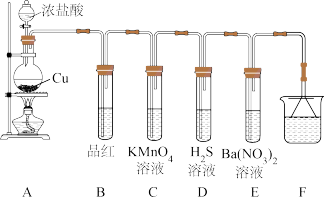
①装置A中烧瓶内反应的化学方程式为_______ 。
②装置D中反应的化学方程式为_______ 。
③E中产生白色沉淀,该白色沉淀的化学成分为_______ (填字母)。
a. b.
b. c.
c. 和
和
设计实验证明你的判断:_______ 。
 是大气污染物之一,但也是重要的化工原料。回答下列问题:
是大气污染物之一,但也是重要的化工原料。回答下列问题:(1)工业生产向大气中排放含有
 的尾气是形成酸雨的原因之一。酸雨的危害巨大,因此工业尾气排放前必须进行净化处理。
的尾气是形成酸雨的原因之一。酸雨的危害巨大,因此工业尾气排放前必须进行净化处理。①下列物质可以用来吸收尾气中
 的是
的是a.
 溶液 b.饱和
溶液 b.饱和 溶液
溶液c.
 溶液 d.饱和
溶液 d.饱和 溶液
溶液②以生石灰为脱硫剂,与尾气中
 反应将硫固定,其产物可作建筑材料。写出该反应的化学方程式:
反应将硫固定,其产物可作建筑材料。写出该反应的化学方程式:(2)某化学兴趣小组为探究
 的性质,设计如图所示装置进行实验。
的性质,设计如图所示装置进行实验。
①装置A中烧瓶内反应的化学方程式为
②装置D中反应的化学方程式为
③E中产生白色沉淀,该白色沉淀的化学成分为
a.
 b.
b. c.
c. 和
和
设计实验证明你的判断:
您最近一年使用:0次
6 . 下列实验操作、现象及解释(或结论)均正确的是
选项 | 实验操作 | 实验现象 | 解释(或结论) |
A | 向2 mL 1 mol/L MgCl2溶液中先加入5滴0.1 mol/L NaOH溶液,再加入5滴0.1 mol/L FeCl3溶液 | 先产生白色沉淀,随后转变为红褐色 | 可证明Ksp:Mg(OH)2>Fe(OH)3 |
B | 将CO2和SO2分别通入Ba(NO3)2溶液来鉴别CO2和SO2 | 均无明显现象 | SO2、CO2与水反应得到的酸均为弱酸,不能 与Ba(NO3)2溶液反应 |
C | 向2支盛有2 mL 5%H2O2溶液中分别滴加5滴0.1 mol/L的Fe2(SO4)3溶液和5滴0.1 mol/L的CuSO4溶液,观察实验现象 | 试管中均产生无色气体,前者较快 | Fe3+和Cu2+均能催化H2O2的分解,前者催化活性更高 |
D | 室温下,用pH试纸分别测定0.1 mol/L的Na2CO3溶液和0.1 mol/L的NaClO溶液的pH | 前者pH比后者大 | 非金属性:Cl>C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-20更新
|
360次组卷
|
2卷引用:山西省运城市2022届高三上学期入学摸底测试化学试题
名校
解题方法
7 . 某Al2O3样品中含有一定量的Cu、Fe,以及少量的Fe2O3。现通过下列生产过程,从该样品中回收铁红。流程如图:
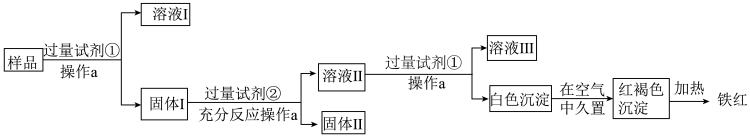
(1)操作a需要的玻璃仪器有烧杯、漏斗、____ 。
(2)溶液Ⅰ中除OH-外还含有大量的阴离子是____ 。
(3)试剂②是____ ,加入试剂②后发生的化学方程式为____ 。
(4)白色沉淀的成分是____ ;写出白色沉淀转化为红褐色沉淀的化学方程式:____ 。
(5)溶液Ⅱ中铁元素的存在形式是____ (填离子符号),如何用实验证明:____ 。

(1)操作a需要的玻璃仪器有烧杯、漏斗、
(2)溶液Ⅰ中除OH-外还含有大量的阴离子是
(3)试剂②是
(4)白色沉淀的成分是
(5)溶液Ⅱ中铁元素的存在形式是
您最近一年使用:0次
名校
解题方法
8 . 已知还原性: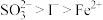 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:
通过实验得出的结论正确的是
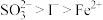 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:| 实验编号 | 操作 | 现象 |
| ① | 取 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| ② | 向实验①的水溶液中加入足量 和 和 溶液 溶液 | 可得到白色沉淀 |
| ③ | 取 原溶液,加入过量的 原溶液,加入过量的 溶液并加热 溶液并加热 | 产生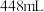 气体(标准状况) 气体(标准状况) |
A.实验①中若通入过量的 ,则可能先后氧化了 ,则可能先后氧化了 、 、 |
B.上述3个实验不能确定是否一定含有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 |
| C.判断溶液中是否含有钾离子,需要通过焰色反应来检验 |
D.实验②能够确定溶液中不含有 |
您最近一年使用:0次
2021-09-10更新
|
485次组卷
|
4卷引用:山西省运城市2022届高三上学期入学摸底测试化学试题
山西省运城市2022届高三上学期入学摸底测试化学试题(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)天津市滨海新区塘沽第一中学2022届高三第一次月考化学试卷江西省新余市第一中学2021-2022学年高三上学期第二次模拟考试化学试题
9 . 根据元素周期表和元素周期律,判断下列叙述不正确的是
| A.气态氢化物的稳定性:H2O>NH3>SiH4 |
| B.氢元素与其他元素可形成共价化合物或离子化合物 |
C.如图所示实验可证明元素的非金属性:Cl>C>Si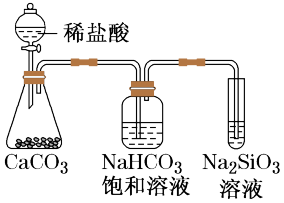 |
D.用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
您最近一年使用:0次
2020-08-02更新
|
5882次组卷
|
112卷引用:山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题
山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期开学考试(8月月考)化学试题山西省临汾第一中学2017-2018学年高一下学期第一次月考化学试题【全国百强校】山西省晋中市平遥中学2018-2019学年高一下学期期中考试化学试题湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期开学考试化学试题山东省菏泽市单县第五中学2020-2021学年高二上学期开学考试化学试题广西桂林市第十八中学2020-2021学年高一下学期开学考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题四川省成都高新实验中学2021-2022学年高三上学期入学考试化学试题山东省济南市平阴县玛钢外国语学校2016-2017学年高一下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(天津卷精编版)福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高一下学期期末联考化学试题陕西省西安中学2018届高三上学期第一次摸底考试化学试题山东省师范大学附属中学2018届高三第三次模拟考试化学试题山东师范大学附属中学2018届高三上学期第三次模拟考试化学试题四川省雅安中学2017-2018学年高二上学期期中考试化学试题福建省莆田第一中学2018届高三上学期第一学段化学试题山东省德州市平原县第一中学2017-2018学年高一4月阶段性检测化学试题河北省唐山一中2017-2018学年高一下学期期中考试化学试题陕西省西安市铁一中2017-2018学年高一下学期期中考试化学试题【全国百强校】天津市第一中学2017-2018学年高一下学期期中考试化学试题(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律【全国百强校】贵州省遵义航天高级中学2017-2018学年高一下学期第三次月考理科综合化学试题(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密【全国市级联考】河南省平顶山市2017-2018学年高一下学期期末考试化学试题【全国百强校】广西壮族自治区桂林市第十八中学2019届高三上学期第一次月考化学试题【全国百强校】吉林省实验中学2019届高三上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】四川省成都外国语学校2018-2019学年高一下学期3月月考化学试题安徽省郎溪县郎溪中学2018-2019学年高一下学期第一次月考化学试题陕西省渭南尚德中学2018-2019学年高一下学期第一次月考化学试题湖南省邵阳市邵东县第一中学2018-2019学年高一下学期第三次月考化学试题【校级联考】黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高一下学期期中考试化学试题黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高一下学期期中考试化学试题(宾县用卷)【校级联考】黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高一下学期期中考试(呼兰用卷)化学试题【校级联考】黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高一下学期期中考试(尚志用卷)化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高一下学期期中考试化学试题百所名校联考-物质结构 元素周期律黑龙江省大庆市第四中学2018-2019学年高一下学期第三次月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题上海市浦外教育集团2018-2019学年高三上学期月考化学试题陕西省榆林市第二中学2020届高三第四次模拟考试化学试题吉林省德惠市实验中学、前郭五中等九校2020届高三上学期期中考试化学试题(已下线)考点13 物质结构 元素周期律 化学键——《备战2020年高考精选考点专项突破题集》河北省衡水市深州市长江中学2020届高三上学期12月月考化学试题贵州省金沙中学2019-2020学年高一上学期期末考试化学试题四川省三台县芦溪中学2018届高三上学期第一次月考理综化学试题人教版高一化学必修2同步练习:第一章第三节《化学键》四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)【南昌新东方】2019 新建一中 高一下期中河北省易县中学2019-2020学年高一4月线上考试(A部)化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期线上考试化学试题安徽省马鞍山市2020届高考第二次模拟理综化学试题(已下线)【南昌新东方】2020 新建二中 高一(下) 第一次月考 005辽宁省大连市普兰店区第一中学2019-2020学年高一上学期期末考试化学试题吉林省辽源市辽县第一高级中学2019-2020高一下学期期中考试化学试题四川省内江市市中区天立学校2019-2020学年高一下学期第二次月考化学试题安徽省定远县育才学校2019-2020学年高一5月月考化学试题安徽省宣城市郎溪县郎溪中学2019-2020学年高一下学期第一次月考化学试题黑龙江省哈尔滨市第六中学校2019-2020学年高二下学期期中考试化学试题广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题湖南省娄底市双峰县第一中学2019-2020学年高一第二次月考化学试题河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考化学试题(B部)安徽省安庆市第一中学2019-2020学年高一下学期月考化学试题四川省广安市邻水县四川省邻水中学2019-2020学年高一下学期期中考试化学试题黑龙江省绥化市2019-2020学年高一下学期期末考试化学试题广西钦州市2019-2020学年高一下学期期末教学质量监测化学(理)试题黑龙江省肇州县第二中学2019-2020学年高一下学期6月月考化学试题河北省冀州中学2020届高三11月月考化学试题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测安徽省阜阳市第十一中学2019-2020学年高一下学期期中考试化学试题新疆生产建设兵团第四师第一中学2019-2020学年高一下学期期中考试化学试题新疆巴音郭楞蒙古自治州第一中学2021届高三上学期期中考试化学试题宁夏银川市开元学校2021届高三上学期第三次月考考试化学试题吉林省长春市第二十九中学2021届高三上学期期末考试化学试题天津市耀华中学2020-2021学年高一上学期期末化学试题新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题江西省赣州市潭口中学2020-2021学年高一下学期第一次月考化学试题广西钦州市浦北县浦北中学2020-2021学年高一3月月考化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)新疆乌鲁木齐市第八中学2020-2021学年高一下学期第一阶段考试化学试题河南省新乡县高级中学2020-2021学年高一下学期第二次月考化学试题(已下线)【浙江新东方】高中化学20210621-019【2021】【高一下】内蒙古集宁新世纪中学2020-2021学年高一下学期期末考试化学试题(已下线)第14讲 元素周期律和元素周期表(练) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题山东省济南市章丘区第四中学2021-2022学年高一下学期第一次质量检测化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题北京市中国人民大学附属中学2021-2022学年高一下学期期中考试化学试题四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题甘肃省高台县第一中学2021-2022学年高一下学期期中考试化学试题(合格考)专题1 揭示物质结构的奥秘 ★第一~三单元综合拔高练山东师范大学附属中学2021-2022学年高一下学期第一次月考化学试题(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)云南省德宏州2020-2021学年高一上学期期末统一监测化学试题云南省广南县第一中学2021-2022学年高三下学期3月考试理综化学试题陕西省西安市临潼区铁路中学2021-2022学年高一下学期5月第二次月考化学试题四川省广元市八二一中学2021-2022学年高一下学期期中考试化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题天津市第七中学2022-2023学年高一上学期期末质量检测化学试题天津市实验中学2022-2023学年高一上学期期末考试化学试题内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题福建省泉州市三校2022-2023学年高二下学期4月期中联考化学试题山东省青岛市39中2022-2023学年高一下学期期中考试化学试题湖南省衡阳市2022-2023学年高一下学期期末检测化学试题章末检测卷(四) 物质结构 元素周期律北京市第二中学2022-2023学年高一下学期期末考试化学试题宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
10 . 根据电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如表所示。
根据表中数据,回答下列问题:
(1)等浓度的F-、 、CH3COO-、HS-结合H+的能力最强的为
、CH3COO-、HS-结合H+的能力最强的为_______ 。
(2)溶液中不可能大量共存的离子组是______ (填序号)。
a. HS-、 b.HF、CH3COO- c. HS-、
b.HF、CH3COO- c. HS-、 d.
d. 、
、
(3)Na2CO3溶液通入过量H2S,反应的离子方程式是______ 。HS-
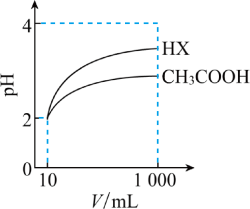
(4)已知pH=-lgc(H+),体积为10mL、pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_______ (填“ ”“
”“ ”或“
”或“ ”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:_______ 。
化学式 | 电离平衡常数 |
HF | 7.2×10-4 |
CH3COOH | 1.8×10-5 |
H2SO3 | K1=1.54×10-2K2=1.02×10-7 |
H2CO3 | K1=4.4×10-7K2=4.7×10-11 |
H2S | K1=1.3×10-7K2=7.1×10-15 |
(1)等浓度的F-、
 、CH3COO-、HS-结合H+的能力最强的为
、CH3COO-、HS-结合H+的能力最强的为(2)溶液中不可能大量共存的离子组是
a. HS-、
 b.HF、CH3COO- c. HS-、
b.HF、CH3COO- c. HS-、 d.
d. 、
、
(3)Na2CO3溶液通入过量H2S,反应的离子方程式是

(4)已知pH=-lgc(H+),体积为10mL、pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数
 ”“
”“ ”或“
”或“ ”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
您最近一年使用:0次
2020-09-20更新
|
814次组卷
|
4卷引用:山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题



