名校
1 . 利用下列装置进行实验,能达到实验目的的是
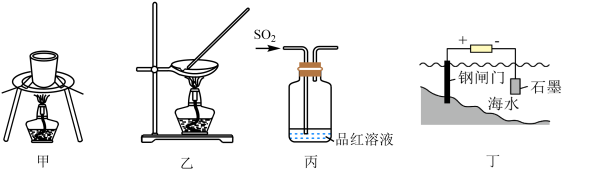

| A.甲装置加热金属钠观察钠燃烧的现象 |
B.乙装置蒸发 溶液制备无水 溶液制备无水 固体 固体 |
C.丙装置验证 的酸性 的酸性 |
| D.丁装置应用电化学原理对钢闸门进行防护 |
您最近一年使用:0次
2023-09-09更新
|
71次组卷
|
2卷引用:山西省运城市2023-2024学年高三上学期开学考试化学试题
名校
解题方法
2 . 根据下列装置和物质,能达到相应实验目的的是
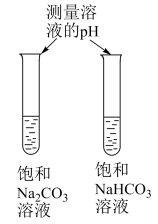 |  |  |  |
A.验证 的水解程度比 的水解程度比 大 大 | B.实验室制备 | C.铁表面镀铜 | D.演示喷泉实验 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-31更新
|
113次组卷
|
3卷引用:山西省大同市2023-2024学年高三上学期开学质量检测化学试题
名校
解题方法
3 . 用下列实验装置进行相应实验,能达到实验目的的是


| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离苯萃取碘水后的混合物 |
您最近一年使用:0次
4 . 用下图实验装置进行相应实验,不能达到实验目的的是
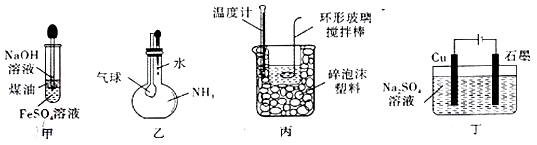

| A.用图甲装置制备氢氧化亚铁 |
| B.用图乙装置验正氨气在水中溶解度的大小 |
| C.用图丙装置进行中和热的测定 |
D.用图丁装置实现反应:Cu+2H2O Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
您最近一年使用:0次
名校
解题方法
5 . 计了如图实验(反应装置如图所示):
Ⅰ.为测定金属钠样品(表面有Na2O)中钠单质的质量分数,设计了如图实验(反应装置如图所示):

①称量A、B的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管(内含无水CaCl2干燥剂)的橡皮塞。有关数据是:投放金属前A、B总质量为ag,称取金属钠样品bg,反应后A、B的总质量为cg。
请根据题意回答下列问题:
(1)A中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:____ 。
(2)用a、b、c表示的钠单质的质量分数为____ 。
(3)如果没有B装置对实验结果有何影响____ 。(填“偏大”或“偏小”“不影响”)
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题:

(4)上述装置Ⅳ中盛放的试剂是____ ,为完成实验应将装置Ⅳ接在____ (填写字母号)。
A.Ⅰ之前 B.Ⅰ和Ⅱ之间 C.Ⅱ和Ⅲ之间 D.Ⅲ之后
(5)点燃酒精灯后,观察到装置Ⅱ中的现象为____ 。
Ⅲ.现用制得纯度较高的Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉____ (填“能”或“不能”)燃烧起来。
(7)盛有0.78gNa2O2、1.68gNaHCO3的固体混合物放在密闭容器中加热,最后固体质量为____ g。
Ⅰ.为测定金属钠样品(表面有Na2O)中钠单质的质量分数,设计了如图实验(反应装置如图所示):

①称量A、B的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管(内含无水CaCl2干燥剂)的橡皮塞。有关数据是:投放金属前A、B总质量为ag,称取金属钠样品bg,反应后A、B的总质量为cg。
请根据题意回答下列问题:
(1)A中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:
(2)用a、b、c表示的钠单质的质量分数为
(3)如果没有B装置对实验结果有何影响
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题:

(4)上述装置Ⅳ中盛放的试剂是
A.Ⅰ之前 B.Ⅰ和Ⅱ之间 C.Ⅱ和Ⅲ之间 D.Ⅲ之后
(5)点燃酒精灯后,观察到装置Ⅱ中的现象为
Ⅲ.现用制得纯度较高的Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉
(7)盛有0.78gNa2O2、1.68gNaHCO3的固体混合物放在密闭容器中加热,最后固体质量为
您最近一年使用:0次
名校
6 . 某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________ 与盐酸反应最剧烈,________ 与盐酸反应产生的气体最多。资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________ 。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:___________________ 。
(3)下列事实能说明氯元素原子得电子能力比硫元素原子强的是________ (填序号)。①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(4)利用下图装置证明非金属性:C>Si,则A中加________ 、B中加Na2CO3、C中加________ ,观察到C中溶液的现象为______________________________________ 。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:
(3)下列事实能说明氯元素原子得电子能力比硫元素原子强的是
(4)利用下图装置证明非金属性:C>Si,则A中加

您最近一年使用:0次
2019-04-15更新
|
206次组卷
|
4卷引用:山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题
山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题【全国百强校】四川省成都外国语学校2018-2019学年高一下学期3月月考化学试题四川省遂宁市射洪县射洪中学校2019-2020学年高一下学期第一次学月考试化学试题(已下线)专题09 元素周期律(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学
名校
7 . 下列实验操作可以达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 探究浓度对反应速率的影响 | 向2支各盛有4mL0.01mol·L-1KMnO4酸性溶液的试管中,分别加入2mL0.1mol·L-1H2C2O4溶液和2mL0.2mol·L-1H2C2O4溶液,记录溶液褪色所需的时间 |
| B | 配制1.00mol·L-1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,然后转移至100mL容量瓶中定容 |
| C | 探究固体表面积对反应速率的影响 | 称取相同质量的大理石和纯碱,加入到盛有浓度、体积均相同的盐酸的小烧杯中,观察实验现象 |
| D | 探究淀粉溶液在稀硫酸和加热条件下是否水解 | 取少量的水解液于试管中,先加适量的NaOH溶液,再滴入碘水,观察实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-02更新
|
1732次组卷
|
5卷引用:山西省太原师范学院附属中学2022-2023学年高二上学期分班考试化学试题
解题方法
8 . 氯化亚铜(CuCl)常用作有机合成工业中的催化剂。工业上由辉铜矿(主要成分为 ,含有
,含有 杂质)制备CuCl的工艺流程如下。
杂质)制备CuCl的工艺流程如下。

已知:i.CuCl是白色粉末,难溶于水和乙醇,在空气中迅速被氧化成绿色固体碱式氯化铜 ;CuCl在水溶液中存在平衡:
;CuCl在水溶液中存在平衡: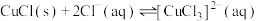
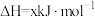 ,
, 为无色离子。
为无色离子。
ⅱ.操作A为向滤液②中加入去氧水(除去氧气的蒸馏水),操作B为用无水乙醇洗涤滤渣②,然后在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。
回答下列问题:
(1)为提高辉铜矿的浸取率,可采用的方法是_______ (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)已知“滤渣①”的成分为 和S,且“浸取”时
和S,且“浸取”时 中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为
中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为_______ 。
(3)已知: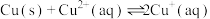
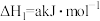
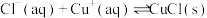
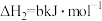
则“还原”时的反应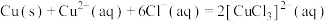 的
的
_______ ;出现_______ 现象时,表明“还原”进行完全。
(4)操作A和操作B除了防止CuCl固体被氧化外,操作A的作用还有_______ ,操作B中采用70℃干燥的目的是_______ 。
(5)CuCl还可用电解法制备,实验装置如图(电解液温度为T℃)。
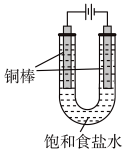
①阳极的电极反应式为_______ 。
②实验开始时,阳极附近没有产生CuOH沉淀的原因是_______ [T℃时,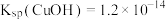 ,
,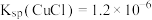 ]。
]。
 ,含有
,含有 杂质)制备CuCl的工艺流程如下。
杂质)制备CuCl的工艺流程如下。
已知:i.CuCl是白色粉末,难溶于水和乙醇,在空气中迅速被氧化成绿色固体碱式氯化铜
 ;CuCl在水溶液中存在平衡:
;CuCl在水溶液中存在平衡: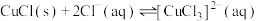
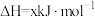 ,
, 为无色离子。
为无色离子。ⅱ.操作A为向滤液②中加入去氧水(除去氧气的蒸馏水),操作B为用无水乙醇洗涤滤渣②,然后在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。
回答下列问题:
(1)为提高辉铜矿的浸取率,可采用的方法是
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)已知“滤渣①”的成分为
 和S,且“浸取”时
和S,且“浸取”时 中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为
中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为(3)已知:
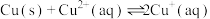
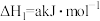
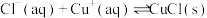
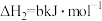
则“还原”时的反应
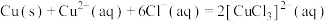 的
的
(4)操作A和操作B除了防止CuCl固体被氧化外,操作A的作用还有
(5)CuCl还可用电解法制备,实验装置如图(电解液温度为T℃)。

①阳极的电极反应式为
②实验开始时,阳极附近没有产生CuOH沉淀的原因是
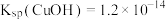 ,
,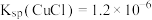 ]。
]。
您最近一年使用:0次
2022-09-08更新
|
290次组卷
|
3卷引用:山西省2022-2023学年高三上学期第一次摸底考试化学试题
山西省2022-2023学年高三上学期第一次摸底考试化学试题山西省运城市2022-2023学年高三入学新生教学质量监测考试化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(15-19)
名校
解题方法
9 .  是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼(
是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼( )和氢氧化钠溶液对酸性
)和氢氧化钠溶液对酸性 蚀刻废液进行综合回收利用,进行
蚀刻废液进行综合回收利用,进行 的制备和NaCl的回收工艺流程如图所示。
的制备和NaCl的回收工艺流程如图所示。
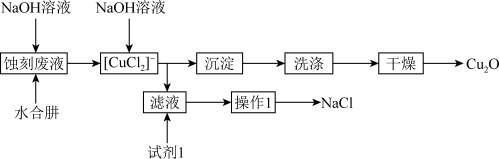
已知: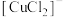 易发生歧化反应。CuOH不稳定,易失水,
易发生歧化反应。CuOH不稳定,易失水,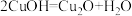 。
。
回答下列问题:
(1)两次加入NaOH溶液的作用分别是:第一次_______ ;第二次_______ 。
(2)验证沉淀已洗涤干净的操作及现象为_______ 。
(3)试剂1为_______ ,操作1为_______ 。
(4)每生成1mol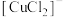 消耗水合肼的物质的量为
消耗水合肼的物质的量为_______ ,用水合肼( )和氢氧化钠溶液进行
)和氢氧化钠溶液进行 制备的总反应的化学方程式为
制备的总反应的化学方程式为_______ 。
(5)已知所制备 的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得
的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得 可能混杂的杂质为
可能混杂的杂质为_______ ,产生该杂质的原因是_______ (用必要的化学用语解释)。
 是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼(
是一种重要无机化工产品,可作防污涂料、着色剂和催化剂等。用水合肼( )和氢氧化钠溶液对酸性
)和氢氧化钠溶液对酸性 蚀刻废液进行综合回收利用,进行
蚀刻废液进行综合回收利用,进行 的制备和NaCl的回收工艺流程如图所示。
的制备和NaCl的回收工艺流程如图所示。
已知:
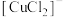 易发生歧化反应。CuOH不稳定,易失水,
易发生歧化反应。CuOH不稳定,易失水,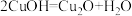 。
。回答下列问题:
(1)两次加入NaOH溶液的作用分别是:第一次
(2)验证沉淀已洗涤干净的操作及现象为
(3)试剂1为
(4)每生成1mol
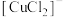 消耗水合肼的物质的量为
消耗水合肼的物质的量为 )和氢氧化钠溶液进行
)和氢氧化钠溶液进行 制备的总反应的化学方程式为
制备的总反应的化学方程式为(5)已知所制备
 的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得
的纯度与第二次加入氢氧化钠溶液的量有关,若加入氢氧化钠溶液不足,则所得 可能混杂的杂质为
可能混杂的杂质为
您最近一年使用:0次
2022-08-10更新
|
180次组卷
|
2卷引用:山西省大同市第二中学校2023届高三上学期开学考试化学试题
10 . 某学习小组通过查阅资料得知CO2与Na2O2之间的反应需要在一定量的水蒸气存在的条件下才能进行,于是他们设计了下列装置对此问题进行探究,同时验证Na2O2与CO2反应的气体产物。
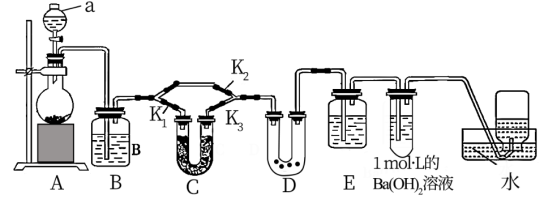
(1)仪器a的名称是_____ ,B中的试剂是_______ ,C中试剂的作用是______ 。
(2)已知Ba(OH)2溶液过量,则盛有Ba(OH)2溶液的试管中发生反应的离子方程式为_______ 。
(3)若要求根据D中现象来确定CO2与Na2O2之间的反应需要在湿润条件下才能进行,对三个止气夹的操作方式为______ ,对应的现象是____ 。
(4)检验气体产物的方法是取出集气瓶并正立在实验台上后,______ 。

(1)仪器a的名称是
(2)已知Ba(OH)2溶液过量,则盛有Ba(OH)2溶液的试管中发生反应的离子方程式为
(3)若要求根据D中现象来确定CO2与Na2O2之间的反应需要在湿润条件下才能进行,对三个止气夹的操作方式为
(4)检验气体产物的方法是取出集气瓶并正立在实验台上后,
您最近一年使用:0次



