1 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
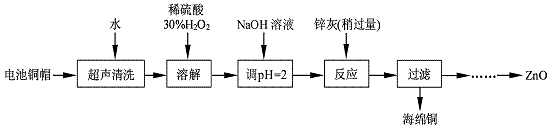
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:_________________ ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为___________ ,滴定终点观察到的现象为_______________ ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
计算电池铜帽中Cu的质量分数为__________ ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会___________ (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=_____ mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②_______________________ ;③过滤;
④______________________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②
④
您最近一年使用:0次
2016-01-25更新
|
258次组卷
|
3卷引用:2017届山西省重点中学协作体高三上学期开学考试化学试卷
名校
2 .  是一种强氧化剂,能分解成
是一种强氧化剂,能分解成 和
和 。图甲表示
。图甲表示 分解时能量与反应进程的关系,图乙为
分解时能量与反应进程的关系,图乙为 酶的相对活性与温度、时间的关系,图丙为相同浓度的
酶的相对活性与温度、时间的关系,图丙为相同浓度的 溶液在
溶液在 时,混合体系中
时,混合体系中 的质量分数与
的质量分数与 、时间的关系。
、时间的关系。

下列说法正确的是
 是一种强氧化剂,能分解成
是一种强氧化剂,能分解成 和
和 。图甲表示
。图甲表示 分解时能量与反应进程的关系,图乙为
分解时能量与反应进程的关系,图乙为 酶的相对活性与温度、时间的关系,图丙为相同浓度的
酶的相对活性与温度、时间的关系,图丙为相同浓度的 溶液在
溶液在 时,混合体系中
时,混合体系中 的质量分数与
的质量分数与 、时间的关系。
、时间的关系。
下列说法正确的是
A.反应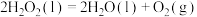 为吸热反应 为吸热反应 |
| B.催化剂改变该反应的活化能和焓变 |
C.相同浓度的 溶液用过氧化氢酶催化时,温度越高分解速率一定越快 溶液用过氧化氢酶催化时,温度越高分解速率一定越快 |
D.其他条件一定,碱性增强有利于 的分解 的分解 |
您最近一年使用:0次
解题方法
3 . 硒被誉为“生命的火种”。亚硒酸钙(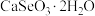 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:

已知部分信息如下:
①含硒废料的主要成分是 和
和 ,“焙烧”中固体产物为
,“焙烧”中固体产物为 、
、 和
和 ;
;
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)“焙烧”时常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ 。“焙烧”中被氧化的元素有___________ (填元素符号)。
(2)“浸渣”的主要成分是___________ (填化学式)。
(3)“沉硒”的化学方程式为___________ 。
(4)洗涤产品时,测定洗涤液pH,当pH为7时可认为产品已洗净,其原理是___________ 。
(5) 热失重时质量与温度的关系如图所示。
热失重时质量与温度的关系如图所示。

380℃时固体的成分是___________ (填化学式)。
(6)测定 产品纯度。
产品纯度。
称取wg产品溶于水,加入足量 溶液和适量稀硝酸,充分反应后,用
溶液和适量稀硝酸,充分反应后,用 溶液滴定至终点,消耗VmL滴定液。
溶液滴定至终点,消耗VmL滴定液。
发生反应:①
②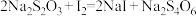
在下列试剂中,宜选择的指示剂为___________ (填标号)。
A. 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液
C. 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
该产品中 的质量分数为
的质量分数为___________ %。
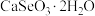 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
已知部分信息如下:
①含硒废料的主要成分是
 和
和 ,“焙烧”中固体产物为
,“焙烧”中固体产物为 、
、 和
和 ;
;②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)“焙烧”时常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
(2)“浸渣”的主要成分是
(3)“沉硒”的化学方程式为
(4)洗涤产品时,测定洗涤液pH,当pH为7时可认为产品已洗净,其原理是
(5)
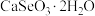 热失重时质量与温度的关系如图所示。
热失重时质量与温度的关系如图所示。
380℃时固体的成分是
(6)测定
 产品纯度。
产品纯度。称取wg产品溶于水,加入足量
 溶液和适量稀硝酸,充分反应后,用
溶液和适量稀硝酸,充分反应后,用 溶液滴定至终点,消耗VmL滴定液。
溶液滴定至终点,消耗VmL滴定液。发生反应:①

②
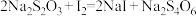
在下列试剂中,宜选择的指示剂为
A.
 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液C.
 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液该产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
4 . 下列说法中,正确的是
| A.化学性质相似的有机物是同系物 |
| B.分子组成相差一个或几个CH2原子团的有机物是同系物 |
| C.若烃中碳、氢元素的质量分数相同,则它们必定是同系物 |
| D.碳原子数不同的烷烃互为同系物 |
您最近一年使用:0次
名校
5 . 下列说法正确的是
| A.相对分子质量相同的两种不同分子一定互为同分异构体 |
| B.各元素质量分数均相同的两种不同分子一定互为同分异构体 |
| C.互为同分异构体的有机物的物理性质一定相似 |
| D.互为同系物的两种分子不可能互为同分异构体 |
您最近一年使用:0次
名校
6 . 已知某可逆反应 ,下图表示外界条件温度、压强的变化对上述反应的影响,则图中y可以表示
,下图表示外界条件温度、压强的变化对上述反应的影响,则图中y可以表示

 ,下图表示外界条件温度、压强的变化对上述反应的影响,则图中y可以表示
,下图表示外界条件温度、压强的变化对上述反应的影响,则图中y可以表示
| A.达到平衡时G的转化率 |
| B.平衡时混合气体中R的质量分数 |
| C.达到平衡时L的转化率 |
| D.平衡时混合气体中G的质量分数 |
您最近一年使用:0次
名校
解题方法
7 . 环戊烯(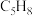 ,
, )是一种重要的有机化工原料,可用环戊二烯(
)是一种重要的有机化工原料,可用环戊二烯(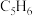 ,
,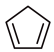 )制备。
)制备。
反应Ⅰ:
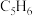 (g,环戊二烯)
(g,环戊二烯)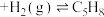 (g,环戊烯)
(g,环戊烯) 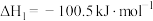
反应Ⅱ:
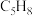 (g,环戊烯)
(g,环戊烯)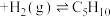 (g,环戊烷)
(g,环戊烷) 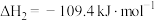
反应Ⅲ:
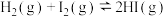
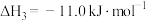
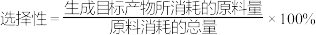
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为a mol)充入容积为2L的恒容密闭容器中,发生反应:
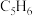 (g,环戊二烯)
(g,环戊二烯)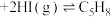 (g,环戊烯)
(g,环戊烯)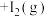 。
。①该反应的△H=
 ,该反应自发进行的条件是
,该反应自发进行的条件是②下列有关该反应的叙述正确的是
A.当气体压强不变时,说明反应已达到平衡状态
B.升高温度,有利于提高环戊烯的平衡产率
C.反应达到平衡时,环戊二烯和碘化氢的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以Pd/
 为催化剂,如图1为25℃时环戊二烯的氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环戊烯的选择性的数据如图2所示。
为催化剂,如图1为25℃时环戊二烯的氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环戊烯的选择性的数据如图2所示。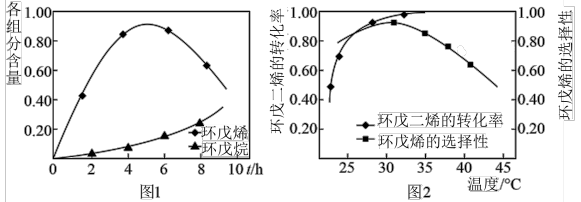
②升高温度,环戊二烯的转化率提高而环戊烯的选择性降低,其原因是
(3)已知两分子环戊二烯易发生加成反应生成二聚体双环戊二烯分子。不同温度(
 、
、 )下,在2L恒容容器中环戊二烯的物质的量与反应时间的关系如图所示(已知起始时环戊二烯的物质的量为1.5mol)。推测
)下,在2L恒容容器中环戊二烯的物质的量与反应时间的关系如图所示(已知起始时环戊二烯的物质的量为1.5mol)。推测
 (填“<”“>”或“=”);
(填“<”“>”或“=”); 时,用二聚体双环戊二烯表示0~1h的平均反应速率v=
时,用二聚体双环戊二烯表示0~1h的平均反应速率v=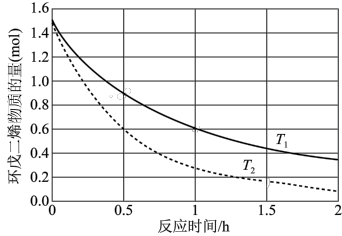


 为用各物质的平衡分压表示反应的平衡常数)。
为用各物质的平衡分压表示反应的平衡常数)。
您最近一年使用:0次
2023-08-04更新
|
190次组卷
|
3卷引用:山西省怀仁市第一中学校2023-2024学年高三上学期开学摸底考试理综化学试题
名校
8 . 某实验小组为了测定已变质的过氧化钠中Na2O2的质量分数,称取ag样品,并设计了如图所示的装置。

(1)装置A中仪器a的名称是___________ ,装置B的作用是___________
(2)将仪器连接好以后,必须进行的操作是___________
(3)写出装置C中发生的反应的化学方程式:___________
(4)实验结束后,在读取生成气体的体积时,你认为合理的是___________ (填字母)。
a.直接读取体积,不需冷却到室温
b.移动量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平
(5)读出量筒内水的体积后,折算成标准状况下气体的体积为VmL,则该样品中过氧化钠的质量分数为___________

(1)装置A中仪器a的名称是
(2)将仪器连接好以后,必须进行的操作是
(3)写出装置C中发生的反应的化学方程式:
(4)实验结束后,在读取生成气体的体积时,你认为合理的是
a.直接读取体积,不需冷却到室温
b.移动量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平
(5)读出量筒内水的体积后,折算成标准状况下气体的体积为VmL,则该样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
9 . 维生素C是重要的营养素,其分子结构如图所示。

(1)维生素C的相对分子质量为_______ ,含氧的质量分数为_______ (保留四位有效数字)。
(2)维生素C含有的官能团的名称为_______ 。
(3)维生素C易溶于水,可能的原因是_______ 。
(4)维生素C具有较强的还原性,向碘和淀粉的混合液中加入过量的维生素C,可以观察到的现象是_______ 。

(1)维生素C的相对分子质量为
(2)维生素C含有的官能团的名称为
(3)维生素C易溶于水,可能的原因是
(4)维生素C具有较强的还原性,向碘和淀粉的混合液中加入过量的维生素C,可以观察到的现象是
您最近一年使用:0次
名校
解题方法
10 . 计了如图实验(反应装置如图所示):
Ⅰ.为测定金属钠样品(表面有Na2O)中钠单质的质量分数,设计了如图实验(反应装置如图所示):

①称量A、B的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管(内含无水CaCl2干燥剂)的橡皮塞。有关数据是:投放金属前A、B总质量为ag,称取金属钠样品bg,反应后A、B的总质量为cg。
请根据题意回答下列问题:
(1)A中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:____ 。
(2)用a、b、c表示的钠单质的质量分数为____ 。
(3)如果没有B装置对实验结果有何影响____ 。(填“偏大”或“偏小”“不影响”)
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题:

(4)上述装置Ⅳ中盛放的试剂是____ ,为完成实验应将装置Ⅳ接在____ (填写字母号)。
A.Ⅰ之前 B.Ⅰ和Ⅱ之间 C.Ⅱ和Ⅲ之间 D.Ⅲ之后
(5)点燃酒精灯后,观察到装置Ⅱ中的现象为____ 。
Ⅲ.现用制得纯度较高的Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉____ (填“能”或“不能”)燃烧起来。
(7)盛有0.78gNa2O2、1.68gNaHCO3的固体混合物放在密闭容器中加热,最后固体质量为____ g。
Ⅰ.为测定金属钠样品(表面有Na2O)中钠单质的质量分数,设计了如图实验(反应装置如图所示):

①称量A、B的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管(内含无水CaCl2干燥剂)的橡皮塞。有关数据是:投放金属前A、B总质量为ag,称取金属钠样品bg,反应后A、B的总质量为cg。
请根据题意回答下列问题:
(1)A中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:
(2)用a、b、c表示的钠单质的质量分数为
(3)如果没有B装置对实验结果有何影响
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题:

(4)上述装置Ⅳ中盛放的试剂是
A.Ⅰ之前 B.Ⅰ和Ⅱ之间 C.Ⅱ和Ⅲ之间 D.Ⅲ之后
(5)点燃酒精灯后,观察到装置Ⅱ中的现象为
Ⅲ.现用制得纯度较高的Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉
(7)盛有0.78gNa2O2、1.68gNaHCO3的固体混合物放在密闭容器中加热,最后固体质量为
您最近一年使用:0次



