解题方法
1 . 乳酸亚铁晶体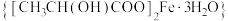 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与 反应制得。
反应制得。
I.制备碳酸亚铁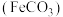
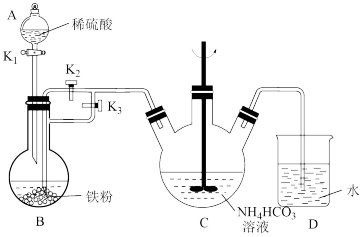
实验步骤如下:
a.检查装置气密性,添加药品,并将导管末端插入D中水面以下;
b.装置B中制取硫酸亚铁,并将整个装置内的空气排净;
c.操作开关,将B中溶液导入C中产生 沉淀;
沉淀;
d.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)甲同学查阅资料了解到Fe(Ⅱ)易被氧化,以上步骤中,他采用了一些操作避免Fe(Ⅱ)被氧化,请摘抄出相关内容_______ 。
(2)仪器C的名称是_______ ,C中生成 的离子方程式是
的离子方程式是_______ 。
(3)步骤b中应打开的开关是_______ (选填“ ”“
”“ ”或“
”或“ ),步骤c中应如何操作开关?
),步骤c中应如何操作开关?_______ (选填“ ”“
”“ ”或“
”或“ )。
)。
II.制备乳酸亚铁晶体
将制得的 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
(4)配制乳酸亚铁溶液时,加入少量铁粉的目的是_______ 。
(5)冷却,加入乙醇的目的是_______ 。
III.探究乳酸亚铁晶体中铁元素的含量
乙同学称取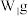 样品溶于水,用
样品溶于水,用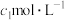 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液 。
。
(6)乙同学方案是否正确?_______ (选填“是”或“否”),如填“是”,计算铁元素的质量分数(用含有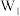 、
、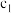 、
、 的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。_______ 。
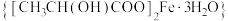 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与 反应制得。
反应制得。I.制备碳酸亚铁
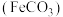

实验步骤如下:
a.检查装置气密性,添加药品,并将导管末端插入D中水面以下;
b.装置B中制取硫酸亚铁,并将整个装置内的空气排净;
c.操作开关,将B中溶液导入C中产生
 沉淀;
沉淀;d.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)甲同学查阅资料了解到Fe(Ⅱ)易被氧化,以上步骤中,他采用了一些操作避免Fe(Ⅱ)被氧化,请摘抄出相关内容
(2)仪器C的名称是
 的离子方程式是
的离子方程式是(3)步骤b中应打开的开关是
 ”“
”“ ”或“
”或“ ),步骤c中应如何操作开关?
),步骤c中应如何操作开关? ”“
”“ ”或“
”或“ )。
)。II.制备乳酸亚铁晶体
将制得的
 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。(4)配制乳酸亚铁溶液时,加入少量铁粉的目的是
(5)冷却,加入乙醇的目的是
III.探究乳酸亚铁晶体中铁元素的含量
乙同学称取
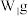 样品溶于水,用
样品溶于水,用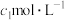 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液 。
。(6)乙同学方案是否正确?
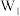 、
、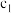 、
、 的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
您最近一年使用:0次
2 . 利用尿素[CO(NH2)2]制备N2H4·H2O(水合肼)的实验流程如下图所示:
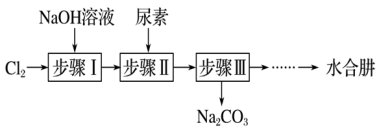
已知:①氯气与烧碱溶液的反应是放热反应;
②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液。该反应的离子方程式为_______ 。实验中,为使步骤I中反应温度不高于40℃,除可采用冷水浴之外,还可采取的措施是_______ 。
(2)N2H4与硫酸形成的酸式盐的化学式为_______ 。
(3)步骤II合成N2H4·H2O。生成水合肼反应的化学方程式为_______ 。
(4)蒸馏得到水合肼粗产品,称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,在一定条件下,用0.15mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,选用的指示剂为_______ 。
②达到滴定终点时消耗碘的标准溶液20.00mL,馏分中N2H4·H2O的质量分数为_______ 。
③下列操作中可能使馏分中水合肼的含量测定结果偏高的是_______ (填编号)。
A.锥形瓶清洗干净后未干燥
B.滴定前,滴定管内无气泡,滴定后有气泡
C.读数时,滴定前平视,滴定后俯视
D.盛标准液的滴定管水洗后,直接装标准液

已知:①氯气与烧碱溶液的反应是放热反应;
②N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液。该反应的离子方程式为
(2)N2H4与硫酸形成的酸式盐的化学式为
(3)步骤II合成N2H4·H2O。生成水合肼反应的化学方程式为
(4)蒸馏得到水合肼粗产品,称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,在一定条件下,用0.15mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,选用的指示剂为
②达到滴定终点时消耗碘的标准溶液20.00mL,馏分中N2H4·H2O的质量分数为
③下列操作中可能使馏分中水合肼的含量测定结果偏高的是
A.锥形瓶清洗干净后未干燥
B.滴定前,滴定管内无气泡,滴定后有气泡
C.读数时,滴定前平视,滴定后俯视
D.盛标准液的滴定管水洗后,直接装标准液
您最近一年使用:0次
2014·陕西西安·二模
名校
3 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
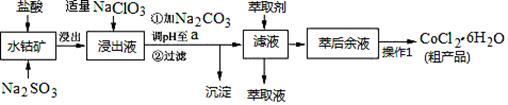
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
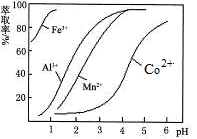
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:2017届湖北省襄阳五中高三上8月开学考化学试卷
4 . 我国科学家侯德榜发明了联合制碱法。以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业作出了卓越贡献。根据要求回答下列问题:
I、用纯净的碳酸钠固体配制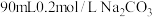 溶液。
溶液。
(1)用托盘天平称取 固体的质量是
固体的质量是_____ 
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和_____ 。
(3)下列说法中,正确的是_____(填字母)。
II、生成纯碱的流程如下: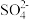 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。
(5)已知:
写出装置I中反应的化学方程式:_____ 。
(6)制出的纯碱中只含有杂质 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。
(7)将碳酸钠和碳酸氢钠的混合物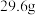 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数_____  (精确到0.1)。
(精确到0.1)。
I、用纯净的碳酸钠固体配制
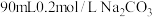 溶液。
溶液。(1)用托盘天平称取
 固体的质量是
固体的质量是
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
(3)下列说法中,正确的是_____(填字母)。
| A.定容时仰视刻度线,会导致配制的溶液浓度偏小 |
| B.定容时如果加水超过刻度线,要用滴管吸出 |
| C.摇匀后发现凹液面下降,再加水至刻度线 |
| D.转移时溶液倒出容量瓶外,要重新配制溶液 |
II、生成纯碱的流程如下:

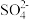 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。| A.①②③④ | B.②①④③ | C.②④①③ | D.④②①③ |
(5)已知:
 |  |  |  | |
| 溶解度(20℃) | 36.0 | 21.7 | 9.6 | 37.2 |
(6)制出的纯碱中只含有杂质
 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。A.取 混合物充分加热,质量减少 混合物充分加热,质量减少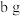 |
B.取 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到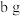 固体 固体 |
C.取 混合物与足量 混合物与足量 溶液充分反应,沉淀经过滤、洗涤、干燥得到 溶液充分反应,沉淀经过滤、洗涤、干燥得到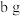 固体 固体 |
D.取 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加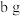 |
(7)将碳酸钠和碳酸氢钠的混合物
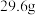 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数 (精确到0.1)。
(精确到0.1)。
您最近一年使用:0次
2024-02-25更新
|
68次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期开学考试化学试题
5 . 碱式碳酸铜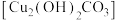 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.配制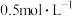 CuSO4溶液和
CuSO4溶液和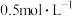 Na2CO3溶液各500 mL
Na2CO3溶液各500 mL
Ⅱ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅲ.探究反应的温度
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅳ.碱式碳酸铜的制备
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的___________ (填仪器名称),还需要补充的玻璃仪器是___________ 。(填仪器名称)___________ ;反应产生“绿色沉淀”碱式碳酸铜的离子反应方程式为___________ 。
(3)步骤Ⅱ中产生蓝色沉淀的成分是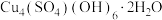 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是___________ 。
(4)步骤Ⅲ中反应的最适宜温度应为___________ ,“实验组⑧”中产物沉淀“绿色偏暗”的原因可能是___________ 。
(5)步骤Ⅳ中检验沉淀是否洗净的操作为___________ 。
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为___________ (已知 ,
, )。
)。
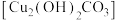 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:Ⅰ.配制
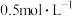 CuSO4溶液和
CuSO4溶液和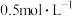 Na2CO3溶液各500 mL
Na2CO3溶液各500 mLⅡ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ① | ② | ③ | ④ |
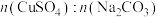 | 1:0.8 | 1:1 | 1:1.2 | 1:1.4 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 0.501 | 0.428 | 0.549 | 0.527 |
| 沉淀颜色 | 蓝色 | 蓝色 | 绿色 | 绿色 |
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ⑤ | ⑥ | ⑦ | ⑧ |
| 温度/℃ | 25 | 65 | 75 | 85 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 无 | 1.303 | 1.451 | 1.28 |
| 沉淀颜色 | 蓝色 | 绿色 | 绿色 | 绿色(偏暗) |
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制
 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的

(3)步骤Ⅱ中产生蓝色沉淀的成分是
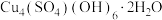 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是(4)步骤Ⅲ中反应的最适宜温度应为
(5)步骤Ⅳ中检验沉淀是否洗净的操作为
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为
 ,
, )。
)。
您最近一年使用:0次
名校
6 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
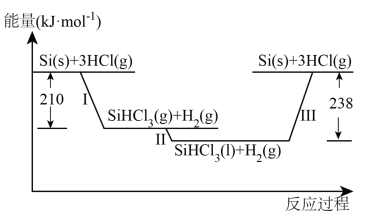
(1)工业上用 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为_______ 。
(2)反应Ⅲ生成2mol Si(s)时,_______ (填“吸收”或“放出”)_______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为_______  。
。
②下列叙述不能说明反应Ⅰ一定达到平衡状态的是_______ (填标号)。
A.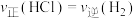 B.硅的质量保持不变
B.硅的质量保持不变
C.HCl的质量分数保持不变 D.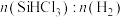 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
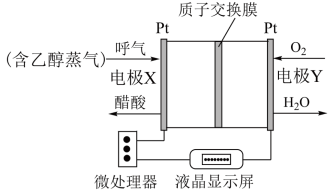
(4)电极X为_______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜_______ (填“从左到右”“从右到左”)迁移。
(6)正极的电极反应式为_______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为(2)反应Ⅲ生成2mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 。
。②下列叙述不能说明反应Ⅰ一定达到平衡状态的是
A.
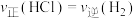 B.硅的质量保持不变
B.硅的质量保持不变C.HCl的质量分数保持不变 D.
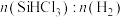 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
7 . 设 为阿伏伽德罗常数的值,下列说法正确的是
为阿伏伽德罗常数的值,下列说法正确的是
 为阿伏伽德罗常数的值,下列说法正确的是
为阿伏伽德罗常数的值,下列说法正确的是A. 晶体中含有共价键数目为 晶体中含有共价键数目为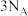 |
B.100g质量分数为17%的 溶液中 溶液中 杂化的原子数约为 杂化的原子数约为 |
C.标准状况下,11.2LNO和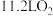 混合后的分子数目为 混合后的分子数目为 |
D.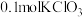 与足量浓盐酸反应生成氯气,转移电子数为 与足量浓盐酸反应生成氯气,转移电子数为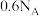 |
您最近一年使用:0次
2023-07-27更新
|
170次组卷
|
2卷引用:湖北武汉市硚口区2023-2024学年高三起点质量检测化学试题
名校
8 . 高铁酸钾( )是一新型、高效、无毒的多功能水处理剂。
)是一新型、高效、无毒的多功能水处理剂。 为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定:
,在碱性溶液中较稳定: 遇KSCN溶液显红色。
遇KSCN溶液显红色。
(1)制备 。
。

①C为制备 装置,KOH溶液过量的原因是
装置,KOH溶液过量的原因是_______ 。
②D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明
。为证明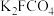 能否氧化
能否氧化 而产生
而产生 ,设计以下方案:
,设计以下方案:
①由方案I中溶液变红可知a中含有_______ ,该离子的产生_______ (填“能”或“不能”)判断一定是由 被
被 还原而形成的。
还原而形成的。
②方案II得出氧化性:
_______  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下,配平及完成上述离子方程式
在硫酸溶液中反应如下,配平及完成上述离子方程式_______ 。

现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.96g气体。则样品中高铁酸钾的质量分数约为_______ 。(计算结果保留到0.1%)
 )是一新型、高效、无毒的多功能水处理剂。
)是一新型、高效、无毒的多功能水处理剂。 为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定:
,在碱性溶液中较稳定: 遇KSCN溶液显红色。
遇KSCN溶液显红色。(1)制备
 。
。
①C为制备
 装置,KOH溶液过量的原因是
装置,KOH溶液过量的原因是②D为尾气处理装置,发生反应的离子方程式为
(2)探究
 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明
。为证明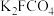 能否氧化
能否氧化 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原而形成的。
还原而形成的。②方案II得出氧化性:

 (填“>”或“<”)
(填“>”或“<”)(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下,配平及完成上述离子方程式
在硫酸溶液中反应如下,配平及完成上述离子方程式
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.96g气体。则样品中高铁酸钾的质量分数约为
您最近一年使用:0次
9 . 下列说法正确的是
①化合物主要包括:酸、碱、盐和氧化物;
②按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
③溶液呈电中性,胶体带有电荷;
④制备 胶体,可向沸水中滴加
胶体,可向沸水中滴加 饱和溶液并长时间煮沸;
饱和溶液并长时间煮沸;
⑤氢氧化铁、有色玻璃和果冻都是胶体;
⑥向饱和 溶液中加入少量无水CaO固体,恢复原温度,溶液中
溶液中加入少量无水CaO固体,恢复原温度,溶液中 的质量分数不变;
的质量分数不变;
⑦醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物;
⑧酸性氯化物不一定是非金属氧化物,碱性氧化物一定是金属氧化物
①化合物主要包括:酸、碱、盐和氧化物;
②按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
③溶液呈电中性,胶体带有电荷;
④制备
 胶体,可向沸水中滴加
胶体,可向沸水中滴加 饱和溶液并长时间煮沸;
饱和溶液并长时间煮沸;⑤氢氧化铁、有色玻璃和果冻都是胶体;
⑥向饱和
 溶液中加入少量无水CaO固体,恢复原温度,溶液中
溶液中加入少量无水CaO固体,恢复原温度,溶液中 的质量分数不变;
的质量分数不变;⑦醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物;
⑧酸性氯化物不一定是非金属氧化物,碱性氧化物一定是金属氧化物
| A.②⑥⑧ | B.①②④⑥ | C.①②④⑦ | D.②⑤⑧ |
您最近一年使用:0次
2022-12-12更新
|
280次组卷
|
3卷引用:湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题
湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题(已下线)云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题
解题方法
10 . NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物。制备NaClO2的装置如图所示:
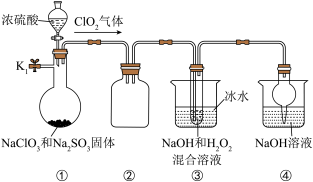
回答下列问题:
(1)仪器组装完毕后必须进行的实验操作是_______ 。
(2)装置②的作用是_______ 。
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为_______ 。
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,_______ 。
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、_______ 、过滤洗涤、干燥等。
(6)晶体以NaClO2•3H2O的形式存在,已知: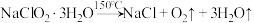 。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是
。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是_______ 。若发生副反应 ,则实验测得的值会
,则实验测得的值会_______ (填“偏大”“偏小”或“不变”)。

回答下列问题:
(1)仪器组装完毕后必须进行的实验操作是
(2)装置②的作用是
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、
(6)晶体以NaClO2•3H2O的形式存在,已知:
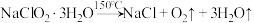 。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是
。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是 ,则实验测得的值会
,则实验测得的值会
您最近一年使用:0次



