解题方法
1 . 氮在自然界中的存在十分广泛。某实验小组对不同含氮物质做了相关研究。请回答下列问题:
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于___________ kJ。
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点________ (填“是”或“不是”)平衡状态;脱氮率a~b段呈现如图变化,原因是_________ 。
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为___________ 。
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于___________ 、___________ 位置。
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为____________ [25℃时,Ksp(AgCl)=1.8×10-10]。用数字传感器探究AgCl的沉淀溶解平衡。实验测得悬浊液中溶解的氯化物浓度变化如图所示,其中a点表示AgCl溶于NH4Cl溶液形成的悬浊液,下列说法正确的是___________ (填字母标号)。
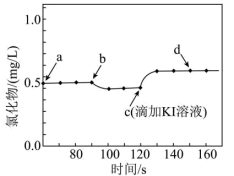
a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)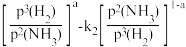 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算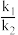 =
=___________ MPa-2(写出计算式即可)。
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为

a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)
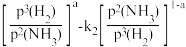 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算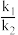 =
=
您最近一年使用:0次
解题方法
2 . 氯化亚铜(CuCl)可用作催化剂、杀菌剂和脱色剂,实验室制备CuCl实验步骤如下:


回答下列问题:
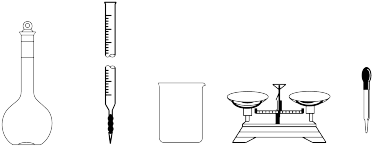
(1)步骤I中,配制0.50 mol/LCuCl2溶液时,不需要使用下列仪器中的___________ (填仪器名称)。
(2)步骤Ⅱ中,充分反应后铜元素转化为无色的[CuCl2]-,其发生可逆反应的离子方程式为___________ 。在加Cu粉前,通常加一定量的NaCl固体,其目的是___________ 。
(3)在进行制备[CuCl2]- 的实验时,为保持安全的实验环境,可以采取的措施是___________ 。
(4)步骤Ⅲ中,用无水乙醇洗涤沉淀的原因是___________ 。
(5)取2.500 g CuCl产品于锥形瓶中,加入稍过量的FeCl3溶液充分反应,再加50 mL水,以邻菲罗啉作指示剂,用1.000 mol/L Ce(SO4)2标准溶液滴定Fe2+,分析样品中CuCl的含量。
已知:滴定原理: Ce4+ +Fe2+ =Ce3++Fe3+; 邻菲罗啉可分别与Fe3+、Fe2+形成浅蓝色和红色的络离子。
①“再加50mL水”的目的是___________ 。
②滴定终点的现象是___________ 。
③若消耗Ce(SO4)2标准溶液的体积为24.00 mL,该样品中CuCl的质量分数是___________ 。


回答下列问题:
(1)步骤I中,配制0.50 mol/LCuCl2溶液时,不需要使用下列仪器中的

(2)步骤Ⅱ中,充分反应后铜元素转化为无色的[CuCl2]-,其发生可逆反应的离子方程式为
(3)在进行制备[CuCl2]- 的实验时,为保持安全的实验环境,可以采取的措施是
(4)步骤Ⅲ中,用无水乙醇洗涤沉淀的原因是
(5)取2.500 g CuCl产品于锥形瓶中,加入稍过量的FeCl3溶液充分反应,再加50 mL水,以邻菲罗啉作指示剂,用1.000 mol/L Ce(SO4)2标准溶液滴定Fe2+,分析样品中CuCl的含量。
已知:滴定原理: Ce4+ +Fe2+ =Ce3++Fe3+; 邻菲罗啉可分别与Fe3+、Fe2+形成浅蓝色和红色的络离子。
①“再加50mL水”的目的是
②滴定终点的现象是
③若消耗Ce(SO4)2标准溶液的体积为24.00 mL,该样品中CuCl的质量分数是
您最近一年使用:0次
解题方法
3 . 氧钒碱式碳酸铵晶体 [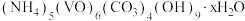 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。
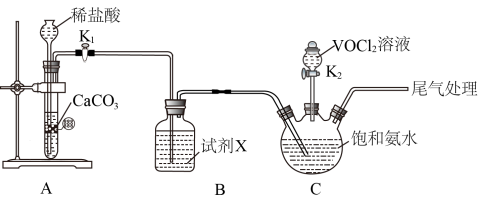
步骤一:按图安装好仪器,添加药品;
步骤二:打开 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;
步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ;试剂X的作用为___________ ; 中V元素的化合价为
中V元素的化合价为___________ 。
(2)步骤二中,通入足量 的作用为
的作用为___________ ;滴加 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用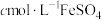 标准溶液滴定(
标准溶液滴定(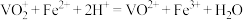 ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为___________ ;产品中钒元素的质量分数为___________ (用代数式表示)。
(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成 的质量为2.184g,则x=
的质量为2.184g,则x=___________ 。
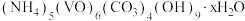 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。

步骤一:按图安装好仪器,添加药品;
步骤二:打开
 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放
 溶液的仪器名称为
溶液的仪器名称为 中V元素的化合价为
中V元素的化合价为(2)步骤二中,通入足量
 的作用为
的作用为 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性
 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用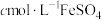 标准溶液滴定(
标准溶液滴定(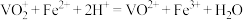 ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成
 的质量为2.184g,则x=
的质量为2.184g,则x=
您最近一年使用:0次
2023-05-20更新
|
252次组卷
|
3卷引用:山西省吕梁市2023届高三下学期三模理科综合化学试题
名校
4 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
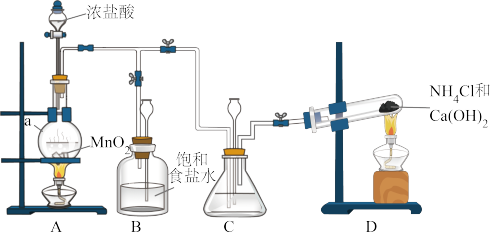
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题
山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题
名校
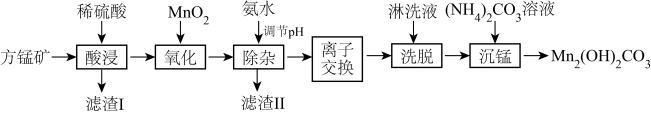
5 . 碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为 MnO,还含有少量的 Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
回答下列问题:
(1)“酸浸”时,滤渣I的成分是___________ (填化学式)。
(2)“氧化”时,该反应的离子方程式为___________ 。
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥______ ;若 A13+沉淀完全时,则溶液中 Fe3+的物质的量浓度为___________ mol·L-1(通常认为溶液中的离子浓度≤1×10-5mol·L-1沉淀完全)
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR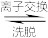 MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为___________ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水”)。
(5)“沉锰”时,反应的离子方程式为___________ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是___________ 。
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
①滴定终点的现象是___________ 。
②该产品中锰的质量分数为___________ 。(用含 a、V 的式子表示)。
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR
 MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)“沉锰”时,反应的离子方程式为
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO
 ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。①滴定终点的现象是
②该产品中锰的质量分数为
您最近一年使用:0次
2022-06-01更新
|
631次组卷
|
4卷引用:山西省太原市第五中学校2022届高三下学期二模理综化学试题
6 . 三草酸合铁(III)酸钾K3[Fe(C2O4)3]•3H2O(其相对分子质量为491),为绿色晶体,易溶于水,难溶于酒精。110℃下可完全失去结晶水,230℃时分解。它还具有光敏性,光照下即发生分解,是制备活性铁催化剂的原料。某化学小组制备该晶体,并测定其中铁的含量,进行如下实验:
I.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL蒸馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O4•2H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O4•2H2O晶体的化学方程式_______ 。检验FeC2O4•2H2O晶体是否洗涤干净的方法是_______ 。
(2)步骤②中检验Fe2+是否完全转化的操作为_______ 。
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是_______ 。
II.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化, 被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中 被还原成Mn2+。
被还原成Mn2+。
步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯_______ ,_______ ,_______ 。
(5)写出步骤三中发生反应的离子方程式_______ 。
(6)实验测得该晶体中铁的质量分数为_______ (结果保留3位有效数字)。
I.三草酸合铁(Ⅲ)酸钾的制备;
①称取5g硫酸亚铁固体,放入到100mL的烧杯中,然后加15mL蒸馏水和5~6滴稀硫酸,加热溶解后,再加入25mL饱和草酸溶液,搅拌加热至沸。停止加热,静置,待析出固体后,抽滤、洗涤、干燥,得到FeC2O4•2H2O;
②向草酸亚铁固体中加入饱和K2C2O4溶液10mL,40oC水浴加热,边搅拌边缓慢滴加20mL3%H2O2溶液,变为深棕色,检验Fe2+是否完全转化为Fe3+,若氧化不完全,再补加适量的H2O2溶液;
③将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95%乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出。晶体完全析出后,抽滤,用乙醇-丙酮混合液洗涤,置于暗处晾干即可。
(1)写出步骤①中,生成FeC2O4•2H2O晶体的化学方程式
(2)步骤②中检验Fe2+是否完全转化的操作为
(3)步骤③用乙醇-丙酮混合液洗涤,而不是用蒸馏水洗涤的原因是
II.铁含量的测定:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化,
 被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+,向反应后的溶液中逐渐加入锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。步骤三:用0.0100mol/LKMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中
 被还原成Mn2+。
被还原成Mn2+。步骤四:重复步骤二、步骤三操作,滴定消耗0.0100mol/LKMnO4溶液19.98mL。
(4)配制三草酸合铁酸钾溶液中用到的玻璃仪器有烧杯
(5)写出步骤三中发生反应的离子方程式
(6)实验测得该晶体中铁的质量分数为
您最近一年使用:0次
2019-10-23更新
|
348次组卷
|
2卷引用:山西省大同十九中2020届高三(3月)线上高考模拟理综化学试题
名校
7 . 我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(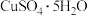 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知: 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____ ,a中的棒香能复燃,说明热分解产物含有_____ (填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____ 。
(3)C中冰水的作用是_____ 。
(4)D中品红溶液褪色,E中有 、
、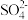 生成,写出E中生成
生成,写出E中生成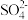 的总的离子方程式:
的总的离子方程式:____ 。
(5)若生成 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____ 。
(6)小组同学用滴定法测定某胆矾样品中 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(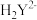 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: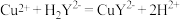 )。
)。
①样品中 的质量分数为
的质量分数为____ %(用含m、V的代数式表示)。
②下列操作会导致 含量的测定结果偏高的是
含量的测定结果偏高的是____ (填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
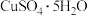 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:
已知:
 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.请回答下列问题:
(1)仪器a的名称是
(2)A中固体由蓝色变为黑色,B中的现象是
(3)C中冰水的作用是
(4)D中品红溶液褪色,E中有
 、
、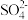 生成,写出E中生成
生成,写出E中生成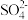 的总的离子方程式:
的总的离子方程式:(5)若生成
 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为(6)小组同学用滴定法测定某胆矾样品中
 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(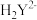 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: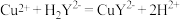 )。
)。①样品中
 的质量分数为
的质量分数为②下列操作会导致
 含量的测定结果偏高的是
含量的测定结果偏高的是a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
2019-04-26更新
|
774次组卷
|
3卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题【市级联考】湖南省益阳市2019届高三下学期4月模考理科综合化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
2012·山西·模拟预测
8 . 以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)写出燃烧黄铁矿的化学方程式________________________________ 。当有6 mol SO2生成时,转移电子_______ mol。
(2)进入接触室的气体中含标准状态下1120 m3SO2气体,达平衡后放出热量为4.728×106 kJ,此时SO2转化率为96%。该反应的热化学方程式为______________ 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)________ 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
e.吸收塔用水作吸收剂
(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O= +2Fe2++4H+
+2Fe2++4H+
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是___________ ?(假设杂质不参加反应)
(5)该生产过程中产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是________。(填字母)

(1)写出燃烧黄铁矿的化学方程式
(2)进入接触室的气体中含标准状态下1120 m3SO2气体,达平衡后放出热量为4.728×106 kJ,此时SO2转化率为96%。该反应的热化学方程式为
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
e.吸收塔用水作吸收剂
(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O=
 +2Fe2++4H+
+2Fe2++4H+ +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O则样品中FeS2的质量分数是
(5)该生产过程中产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是________。(填字母)
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞 |
您最近一年使用:0次
9 . 三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
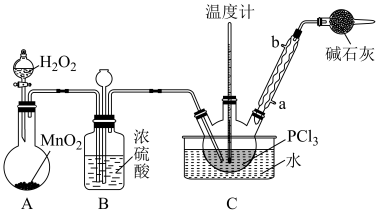
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)> Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
(1)POCl3遇水反应的化学方程式为_________________________________________ 。
(2)装置B的作用除干燥O2外,还有_________________________________________ 。干燥管的作用是_______________ 。
(3)反应温度要控制在60~65℃,原因是_____________________________________________ 。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________ 。若无此操作,所测产品中氯元素的质量分数将会__________ (填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________ , 产品中POCl3的质量分数为____________ 。
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:

已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)> Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置B的作用除干燥O2外,还有
(3)反应温度要控制在60~65℃,原因是
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(4)步骤③中加入硝基苯的作用是
(5)步骤④中X为
您最近一年使用:0次
解题方法
10 . 三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3,PCl3、POCl3的部分性质如下:
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
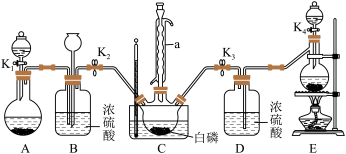
(1)仪器a 的名称为_______________ ,B装置中长颈漏斗的作用是___________________ 。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________ 。
(3)为使实验顺利进行,还需补充的装置为____________________ 。
(4)反应时,需严格控制三个条件:
①先制取___________ ,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是________ 。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________ (写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________ (写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
| 熔点/℃ | 沸点/℃ | 其他 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |

(1)仪器a 的名称为
(2)装置E用来制取Cl2,反应的离子方程式为
(3)为使实验顺利进行,还需补充的装置为
(4)反应时,需严格控制三个条件:
①先制取
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
您最近一年使用:0次



