解题方法
1 . 化学与人类生活息息相关。下列有关物质性质与用途具有对应关系的是
| 选项 | 用途 | 性质 |
| A | 常用甲苯除去家具表面油漆斑点 | 甲苯易挥发 |
| B | 小苏打可以缓解服用阿司匹林引起的酸中毒 |  受热易分解 受热易分解 |
| C | 活性炭粉除去汽车、冰箱里异味 | 活性炭具有强还原性 |
| D | 维生素C常作食品抗氧化剂 | 维生素 易与 易与 反应 反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 化学与生活密切相关。下列对应关系正确的是
| 选项 | 实际应用 | 解释 |
| A | 水泥砂浆用作建筑黏合剂 | Na2SiO2具有黏性 |
| B | 医疗上双氧水用于伤口消毒 | H2O2能使蛋白质变性 |
| C | NH3用作食品加工的制冷剂 | NH3具有还原性 |
| D | 铝用作飞机、火箭的结构材料 | 铝易发生钝化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列实验操作,实验现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 | 有银镜生成 | 蔗糖已经完全水解为具有还原性的葡萄糖 |
| B | 检验HCl气体中是否含有CO2,可将气体通入Ca(OH)2溶液中 | 没有出现白色沉淀 | 证明不含有CO2 |
| C | 强酸性溶液X中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀,后溶液又变红 | X中一定含有SO42-和Fe3+ |
| D | 检验HCl气体中是否含有Cl2,可将气体通入品红溶液中,然后加热 | 品红溶液褪色,加热后溶液不恢复成红色 | 证明含有Cl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 乙醛(CH3CHO)是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
(1)已知:①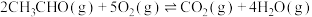 ;ΔH1
;ΔH1
② ;ΔH2
;ΔH2
③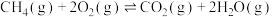 ;ΔH3
;ΔH3
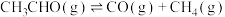 ;ΔH=
;ΔH=___________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
(3)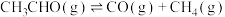 速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=-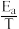 (R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与
(R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与 关系如图所示。催化剂效能较高的是
关系如图所示。催化剂效能较高的是___________ (填“Cat1”或“Cat2”),判断依据是___________ 。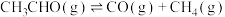 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:
已知:一步进行的反应称为基元反应,基元反应中反应级数等于反应物的化学计量数之和。下列叙述正确的是___________ (填标号)。
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应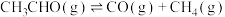 ,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。
,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。___________ 。该温度下,上述反应M点平衡常数Kp=___________ kPa(Kp用分压计算的平衡常数,分压=总压×物质的量分数)。
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应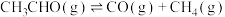 ,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:
,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:___________ 。
(1)已知:①
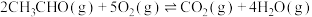 ;ΔH1
;ΔH1②
 ;ΔH2
;ΔH2③
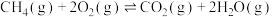 ;ΔH3
;ΔH3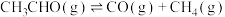 ;ΔH=
;ΔH=(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
| A.气体压强不随时间变化时达到平衡状态 |
| B.平衡后充入氖气,平衡向逆反应方向移动 |
| C.上述可逆反应的正反应是熵增反应 |
| D.平衡后,充入少量H2,CH3CHO平衡转化率增大 |
(3)
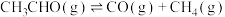 速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=-
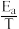 (R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与
(R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与 关系如图所示。催化剂效能较高的是
关系如图所示。催化剂效能较高的是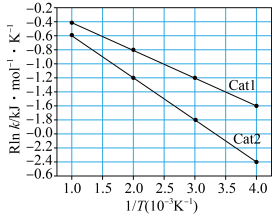
 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:| c(CH3CHO)/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| v/mol·L-1·s-1 | 0.020 | 0.080 | 0.182 | 0.318 |
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应
 ,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。
,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。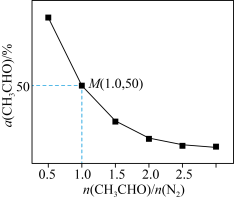
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应
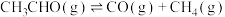 ,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:
,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因: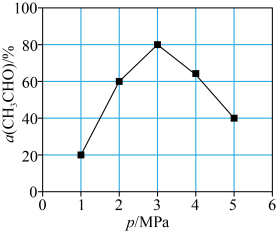
您最近一年使用:0次
名校
5 . 以湿法炼锌厂所产的钴锰渣(主要成分为 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: ,
, ,
,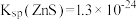 。
。
回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调pH”过程中得到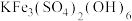 沉淀的离子方程式为
沉淀的离子方程式为_______ 。
(3)若 溶液的
溶液的 ,试分析
,试分析 主要以
主要以______ [填“ ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由______ 。
(4)“滤渣3”中含有S、 ,写出得到
,写出得到 的化学方程式
的化学方程式______ 。
(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。______ 。
②“萃余液2”中的主要成分为______ (填化学式),指出分离钴镍的合适pH范围为______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7
 、
、 、
、 、
、 ,含少量
,含少量 、
、 、
、 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: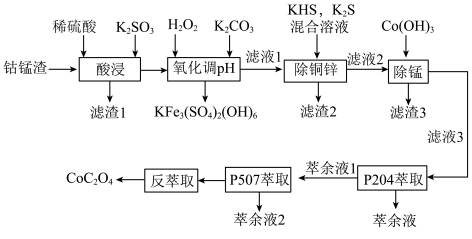
 ,
,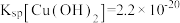 ,
,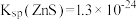 。
。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调pH”过程中得到
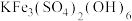 沉淀的离子方程式为
沉淀的离子方程式为(3)若
 溶液的
溶液的 ,试分析
,试分析 主要以
主要以 ”或“
”或“ ”]形式除去,通过计算说明你的理由
”]形式除去,通过计算说明你的理由(4)“滤渣3”中含有S、
 ,写出得到
,写出得到 的化学方程式
的化学方程式(5)P5O4、P5O7对金属离子的萃取率与pH的关系如图所示。
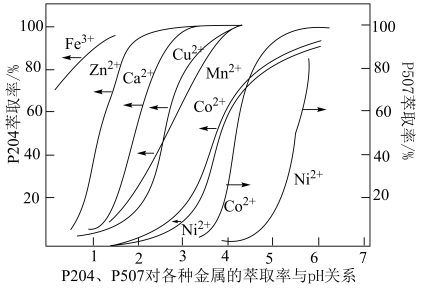
②“萃余液2”中的主要成分为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
6 . 氮、溴、锌等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。卟啉锌超分子结构如图所示。下列说法中正确的是


| A.卟啉锌超分子中各原子均满足8电子稳定结构 |
| B.卟啉锌超分子中的碳原子采取的杂化方式为sp2、sp3 |
| C.图中①②③④处的化学键均属于配位键 |
| D.卟啉锌超分子中所含元素均处于元素周期表的p区 |
您最近一年使用:0次
名校
解题方法
7 . 硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在 气氛中,
气氛中, 的脱水热分解过程如图所示:
的脱水热分解过程如图所示:
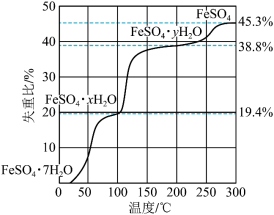
根据上述实验结果,可知x=___________ ,y=___________ 。
(2)已知下列热化学方程式:

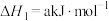



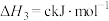
则 的
的
___________  。
。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时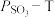 的关系如下图所示。
的关系如下图所示。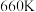 时,该反应的平衡总压
时,该反应的平衡总压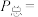
___________  、平衡常数
、平衡常数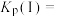
___________  。
。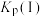 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不変”)。

(4)提高温度,上述容器中进一步发生反应 ,在
,在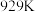 达到平衡时,
达到平衡时, 、
、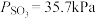 ,则
,则
___________  ,
,
___________  (列出计算式)。
(列出计算式)。
(1)在
 气氛中,
气氛中, 的脱水热分解过程如图所示:
的脱水热分解过程如图所示:
根据上述实验结果,可知x=
(2)已知下列热化学方程式:

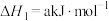



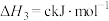
则
 的
的
 。
。(3)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时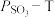 的关系如下图所示。
的关系如下图所示。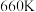 时,该反应的平衡总压
时,该反应的平衡总压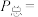
 、平衡常数
、平衡常数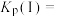
 。
。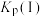 随反应温度升高而
随反应温度升高而
(4)提高温度,上述容器中进一步发生反应
 ,在
,在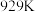 达到平衡时,
达到平衡时, 、
、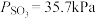 ,则
,则
 ,
,
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
8 . 乙醇用途广泛且需求量大,CO2电催化制备乙醇,电解原理如图所示,下列说法错误的是
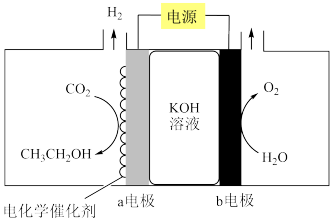

| A.b电极与电源正极相连 |
| B.阳极区溶液的pH在增大 |
| C.a电极的电极反应为2CO2+9H2O+12e-=C2H5OH+12OH- |
| D.更换高选择性的电化学催化剂可以抑制a电极发生析氢腐蚀 |
您最近一年使用:0次
解题方法
9 . 氮在自然界中的存在十分广泛。某实验小组对不同含氮物质做了相关研究。请回答下列问题:
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于___________ kJ。
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点________ (填“是”或“不是”)平衡状态;脱氮率a~b段呈现如图变化,原因是_________ 。
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为___________ 。
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于___________ 、___________ 位置。
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为____________ [25℃时,Ksp(AgCl)=1.8×10-10]。用数字传感器探究AgCl的沉淀溶解平衡。实验测得悬浊液中溶解的氯化物浓度变化如图所示,其中a点表示AgCl溶于NH4Cl溶液形成的悬浊液,下列说法正确的是___________ (填字母标号)。
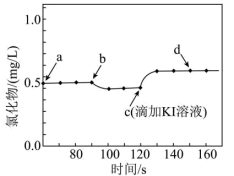
a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)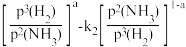 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算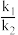 =
=___________ MPa-2(写出计算式即可)。
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为

a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)
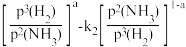 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算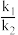 =
=
您最近一年使用:0次
10 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
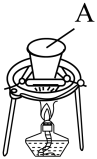
(1)A可选用_______ (填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为_______ 。
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为_______ ;检验K2MnO4歧化完全的实验方法是_______ 。
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应: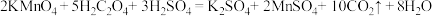 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]
(4)配制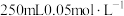 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是_______ (填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于_______ 。
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:
_______ 。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。

(1)A可选用
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:
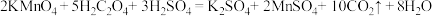 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录的数据]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
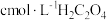 溶液 溶液 |  | 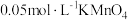 溶液 溶液 | 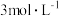 稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
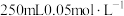 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:

您最近一年使用:0次
2023-05-11更新
|
327次组卷
|
3卷引用:山西省晋城市2023届高三下学期第三次模拟考试理科综合化学试题



