1 . 化学与生产、生活密切相关。下列对应关系错误的是
| A.过氧化钠——可用作供氧剂 |
| B.建水紫陶——耐任何酸碱腐蚀 |
| C.青铜器牛虎铜案——硬度高于纯铜 |
| D.厨余垃圾堆肥——涉及氧化还原反应 |
您最近一年使用:0次
名校
2 . 化学在生活中有着广泛的应用,下列对应关系正确的是( )
| A.SO2具有漂白性,可用SO2漂白食物 |
| B.明矾、二氧化氯可作水杀菌消毒剂 |
| C.地沟油中的“油”属于油脂,用地沟油可制造肥皂 |
| D.碳酸钠能与盐酸反应,可用碳酸钠治疗胃酸过多 |
您最近一年使用:0次
2018-03-27更新
|
470次组卷
|
2卷引用:云南省曲靖市2018届高三第一次复习统一检测理科综合化学试题
3 . 化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A | 肥皂水显碱性 | 作蚊虫叮咬的清洗剂 |
B | NaHCO3能与碱反应 | NaHCO3用作疏松剂 |
C | Al(OH)3受热分解吸收大量热量 | Al(OH)3可作阻燃剂 |
D | 酸性高锰酸钾溶液能氧化乙烯 | 使用酸性高锰酸钾溶液延长水果保存时间 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列科学性与其重要贡献对应关系错误的是
| A.屠呦呦创制新型抗疟疾药青蒿素和双氢青蒿素 |
| B.阿伏加德罗 提出苯分子是由6个碳原子以单、双键相互交替结合而成的环状结构 |
| C.拉瓦锡创立氧化说以解释燃烧等实验现象,推翻了燃素说,验证了质量守恒定律 |
| D.门捷列夫发现化学元素的周期性并依照相对原子质量制作出世界上第一张元素周期表 |
您最近一年使用:0次
5 . 硒化锌(ZnSe)常用作荧光粉、电子工业掺杂材料和高纯试剂,也是一种重要的半导体材料。其中以锌矿(主要成分是ZnS,含少量 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
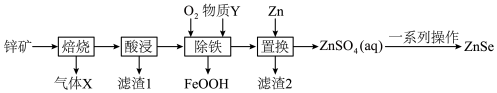
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是_______ ,基态Zn原子的价层电子排布式为_______ 。
(2)写出气体X的一种用途_______ 。
(3)浸出液中含有 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为_______ ,同时需补充适量物质Y,Y是_______ (写出一种即可)。“除铁”最佳pH为3.0,如果pH过高,会导致溶液中 的含量降低,其主要原因是
的含量降低,其主要原因是_______ 。
(4)“置换”时滤渣2的主要成分为_______ 。也可以在酸性含 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成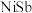 ,其离子方程式为
,其离子方程式为_______ 。
(5) 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
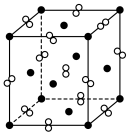
晶胞的密度ρ=_______ g·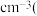 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为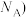 。
。
 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是
(2)写出气体X的一种用途
(3)浸出液中含有
 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为 的含量降低,其主要原因是
的含量降低,其主要原因是(4)“置换”时滤渣2的主要成分为
 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成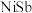 ,其离子方程式为
,其离子方程式为(5)
 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
晶胞的密度ρ=
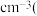 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为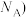 。
。
您最近一年使用:0次
6 . 近年来,人们发现 不仅在颜料、防腐工业等方面具有广泛的用途,而且
不仅在颜料、防腐工业等方面具有广泛的用途,而且 的大单晶体是一种很重要的电光调制晶体,也是有机合成中性能优良的催化剂。研究发现一种利用低品位铜矿(含
的大单晶体是一种很重要的电光调制晶体,也是有机合成中性能优良的催化剂。研究发现一种利用低品位铜矿(含 、
、 和
和 等)为原料制取
等)为原料制取 的工艺流程如下:
的工艺流程如下:
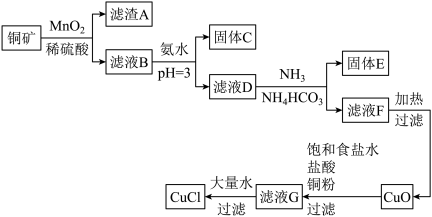
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时, 的溶度积常数
的溶度积常数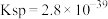 。
。
(1)铜矿中未被 氧化的物质有
氧化的物质有___________ 。
(2)滤液D中铁离子的浓度约为___________ 。
(3)向滤液D中先通氨气的目的是___________。
(4)固体E主要是 ,生成
,生成 的离子方程式是
的离子方程式是___________ 。
(5)滤液F加热生成 、
、 和
和 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(6)若要制取99.5g ,理论上至少需要质量分数为25%的
,理论上至少需要质量分数为25%的 的铜矿粉的质量为
的铜矿粉的质量为___________ g。
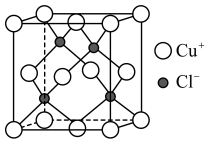
(7)查阅资料: 立方晶胞结构如下图所示,其晶胞参数为apm,
立方晶胞结构如下图所示,其晶胞参数为apm, 以配位键与
以配位键与 相结合,其中
相结合,其中 的配位数为
的配位数为___________ , 晶体密度为
晶体密度为___________  。
。
 不仅在颜料、防腐工业等方面具有广泛的用途,而且
不仅在颜料、防腐工业等方面具有广泛的用途,而且 的大单晶体是一种很重要的电光调制晶体,也是有机合成中性能优良的催化剂。研究发现一种利用低品位铜矿(含
的大单晶体是一种很重要的电光调制晶体,也是有机合成中性能优良的催化剂。研究发现一种利用低品位铜矿(含 、
、 和
和 等)为原料制取
等)为原料制取 的工艺流程如下:
的工艺流程如下:
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,
 的溶度积常数
的溶度积常数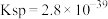 。
。(1)铜矿中未被
 氧化的物质有
氧化的物质有(2)滤液D中铁离子的浓度约为
(3)向滤液D中先通氨气的目的是___________。
A.中和溶液中的 | B.调节溶液 值,生成 值,生成 沉淀 沉淀 |
C.有利于 的生成 的生成 | D.增加 的溶解度 的溶解度 |
(4)固体E主要是
 ,生成
,生成 的离子方程式是
的离子方程式是(5)滤液F加热生成
 、
、 和
和 ,反应的化学方程式是
,反应的化学方程式是(6)若要制取99.5g
 ,理论上至少需要质量分数为25%的
,理论上至少需要质量分数为25%的 的铜矿粉的质量为
的铜矿粉的质量为(7)查阅资料:
 立方晶胞结构如下图所示,其晶胞参数为apm,
立方晶胞结构如下图所示,其晶胞参数为apm, 以配位键与
以配位键与 相结合,其中
相结合,其中 的配位数为
的配位数为 晶体密度为
晶体密度为 。
。
您最近一年使用:0次
名校
解题方法
7 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: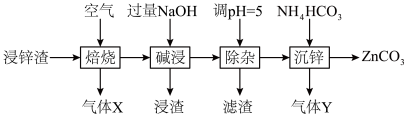
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):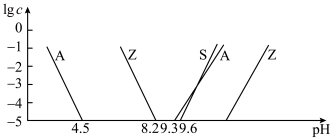
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-04-21更新
|
230次组卷
|
3卷引用:云南省罗平第一中学2024年高三二模考试化学试题
名校
8 . 阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为如图所示:

下列说法不正确的是

下列说法不正确的是
A.香兰素、阿魏酸均可与 溶液反应 溶液反应 |
| B.阿魏酸中存在顺反异构,与氢气完全加成后的产物含手性碳原子 |
| C.阿魏酸的加聚产物不能使溴水褪色 |
| D.与香兰素互为同分异构体,分子中有5种不同化学环境的氢,且能发生银镜反应的酚类化合物有4种 |
您最近一年使用:0次
2023-06-27更新
|
325次组卷
|
3卷引用:云南省三校2024届高三上学期备考实用性联考(一)化学试题
解题方法
9 . 硫酸羟胺[(NH3OH)2SO4]为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是___________ ,装置C中反应的化学方程式为___________ 。
(2)开始实验时,应最先打开___________ (填“K1”“K2”或“K3”)。
(3)流程中步骤I的化学方程式是___________ 。
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是___________ (填“NH2OH·H2O”或“NH3·H2O”);再加入甲醇,析出___________ (填化学式)晶体,过滤,滤液经___________ (填“常压”或“减压”)蒸馏后,加入硫酸,得到硫酸羟胺产品。
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=___________ mol。

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是
(2)开始实验时,应最先打开
(3)流程中步骤I的化学方程式是
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
您最近一年使用:0次
解题方法
10 . 以对硝基苯甲酸( )为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(
)为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(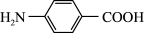 )的装置如图,下列说法不正确的是
)的装置如图,下列说法不正确的是

 )为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(
)为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸( )的装置如图,下列说法不正确的是
)的装置如图,下列说法不正确的是
| A.反应结束后阳极区 pH减小 |
| B.电子由金属阳极DSA经导线流入直流电源 |
C.阴极的主要电极反应式为: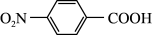 +6e—+6H+→ +6e—+6H+→ +2H2O +2H2O |
| D.每转移1 mol e—时,阳极电解质溶液的质量减少8g |
您最近一年使用:0次
2022-07-26更新
|
642次组卷
|
3卷引用:云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题
云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题云南省保山市2022届高三上学期第一次教学质量监测理综化学试题(已下线)专题讲座(六) 电解质介质和隔膜在电化学的作用(讲)-2023年高考化学一轮复习讲练测(全国通用)



