名校
解题方法
1 . 下列有关物质性质与用途具有对应关系的是
A. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 |
B. 显碱性,可用作制冷剂 显碱性,可用作制冷剂 |
C. 熔点高,可用于做耐高温材料 熔点高,可用于做耐高温材料 |
D. 具有氧化性,可用于自来水的杀菌消毒 具有氧化性,可用于自来水的杀菌消毒 |
您最近一年使用:0次
名校
2 . 下列有关物质性质与应用的对应关系错误的是
| 选项 | 性质 | 实际应用 |
| A | 二氧化氯具有强氧化性 | 可用作饮用水消毒 |
| B |  能与盐酸反应 能与盐酸反应 | 可用作胃酸中和剂 |
| C | 石英坩埚耐高温 | 可用于加热熔化烧碱、纯碱等固体 |
| D |  受热分解,生成高熔点物质和水 受热分解,生成高熔点物质和水 |  可用为原料制作塑料的阻燃剂 可用为原料制作塑料的阻燃剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 化学在生活中有着广泛的应用,下列对应关系正确的是
| 化学性质 | 实际应用 | |
| A | SiO2是酸性氧化物 | 生产光导纤维 |
| B | Fe2(SO2)3易水解 | 脱除天然气中H2S |
| C | 乙烯能发生加聚反应 | 用作水果的催熟剂 |
| D | NH3具有还原性 | 将柴油车尾气中NO转化为N2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-01更新
|
102次组卷
|
2卷引用:宁夏固原一中2020届高三第二次冲刺考试理综化学试题
真题
名校
4 . 下表中对应关系正确的是
| A | CH3CH3+Cl2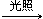 CH3CH2Cl+HCl CH3CH2Cl+HClCH2=CH2+HCl  CH3CH2Cl CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br‾=2Cl‾+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O+4NaOH+O2↑ Cl2+H2O=HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
1737次组卷
|
16卷引用:宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题
宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题西藏山南市第二高级中学2020届高三第一次模拟考试理综化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)2016届安徽省合肥一中等六校教研会高三第一次联考化学试卷2016届河北省张家口市四校高三上学期联考化学试卷2015-2016学年四川省南充市高二上学期期末考试化学试卷2016-2017学年湖北省宜昌一中高二上开学测化学试卷山东省淄博市淄川中学2016-2017学年高二下学期学分认定(期末)考试化学试题陕西省西安市第一中学2018届高三上学期第二次模拟考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】【全国百强校】西藏自治区拉萨市北京实验中学2019届高三上学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (教学案)(已下线)上海市格致中学2015届高三上学期摸底考试化学试题内蒙古阿拉善盟2020届高三上学期月考化学试题安徽省宣城市2019-2020学年高一下学期期末考试化学试题吉林省乾安县第七中学2020-2021学年高一下学期第六次质量检测化学试卷
5 . 化学在生活中有着广泛的应用,下列物质性质与应用对应关系错误的是
| A.硅胶吸水能力强,可作食品干燥剂 |
| B.CaO能与SO2反应,可作工业废气脱硫剂 |
| C.聚四氟乙烯耐高温、耐腐蚀、不粘附、无毒害,可用于厨具表面涂层 |
| D.Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂 |
您最近一年使用:0次
名校
解题方法
6 . 下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
| D | 向水玻璃溶液中通入足量CO2后,产生白色浑浊 | 生成了硅酸沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
584次组卷
|
6卷引用:2016届宁夏石嘴山三中高三下第一次模拟理综化学试卷
名校
7 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
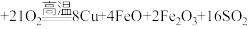 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为___________ ,基态铜原子核外电子的空间运动状态(原子轨道)有___________ 种。
(2)高温下CuO能转化为 的原因是
的原因是___________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是___________ ,1360℃是___________ 的熔点。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为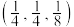 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为___________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

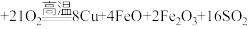 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为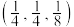 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
8 . 过渡元素在现代工农业生产和科技发展方面具有重要的用途。回答下列问题:
(1)已知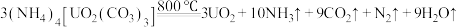 。
。
①基态U原子的外围电子排布式为 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是___________ (填标号)。
A. B.
B. 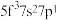 C.
C. 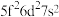 D.
D. 
②反应中断裂的化学键有___________ (填标号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
③反应所得的气态产物中属于非极性分子的是___________ (填化学式,下同);氢化物中更易与 形成配离子的是
形成配离子的是___________ 。向 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式___________ 。
(2)一个配体中有两个配位原子的配体叫双齿配体,C2O 就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为
就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为___________
(3)四羰基镍 是制备铂镍合金的重要原料之一,
是制备铂镍合金的重要原料之一, 为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是
为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是___________ 。
(4)铑掺杂SrTiO3形成的催化剂,在光催化CO2还原反应中有很高的催化效率。SrTiO3的晶胞结构如图所示。其中Sr2+位于晶胞的体心,当有1%的Ti4+被Rh3+替代后,晶体中会失去部分O2-产生缺陷,此时平均每个晶胞所含O2-数目为___________ (保留三位小数)。

(1)已知
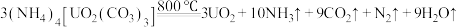 。
。①基态U原子的外围电子排布式为
 ,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是
,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是A.
 B.
B. 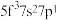 C.
C. 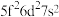 D.
D. 
②反应中断裂的化学键有
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
③反应所得的气态产物中属于非极性分子的是
 形成配离子的是
形成配离子的是 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式(2)一个配体中有两个配位原子的配体叫双齿配体,C2O
 就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为
就是一种双齿配体。Fe3+的配位数是6,硫酸铁溶液中加入H2C2O4后生成配离子的化学式为(3)四羰基镍
 是制备铂镍合金的重要原料之一,
是制备铂镍合金的重要原料之一, 为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是
为无色有挥发性的剧毒液体,呈四面体构型。熔点25℃,沸点42℃。四羰基镍的晶体类型是(4)铑掺杂SrTiO3形成的催化剂,在光催化CO2还原反应中有很高的催化效率。SrTiO3的晶胞结构如图所示。其中Sr2+位于晶胞的体心,当有1%的Ti4+被Rh3+替代后,晶体中会失去部分O2-产生缺陷,此时平均每个晶胞所含O2-数目为

您最近一年使用:0次
2024-04-03更新
|
277次组卷
|
2卷引用:宁夏银川市银川一中2024届高三一模理综-化学试题
名校
9 . 下列关于物质的性质、用途等描述中不正确的是
| A.SO2具有还原性,并且可以杀菌、抗氧化,在葡萄酒中添加适量的SO2能杀灭微生物并防止葡萄酒的氧化变质 |
B.高铁酸钾 在水处理过程中涉及的变化过程有:氧化还原反应、蛋白质变性、盐类水解、胶体聚沉等 在水处理过程中涉及的变化过程有:氧化还原反应、蛋白质变性、盐类水解、胶体聚沉等 |
| C.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料 |
D.液氨作为清洁能源的反应原理是 |
您最近一年使用:0次
2023-10-09更新
|
498次组卷
|
4卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
10 . 铬及其化合物有许多独特的性质和用途。如炼钢时加入一定量的铬可得到不锈钢,K2Cr2O7是实验中常用的强氧化剂之一,利用含有铬、锌、钢、铁、镉(Cd)、钴(Co)等单质的工业废料回收铬的生产流程如图:
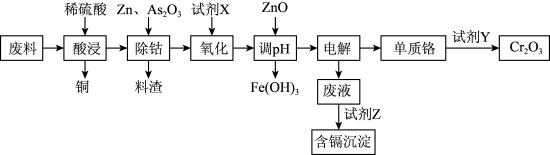
几种金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)写出提高酸浸速率的措施_______ (写出两点)。
(2)酸浸时形成的金属离子的价态均相同,料渣中含有大量的CoAs合金,写出除钴时反应的离子方程式_______ ;若仅从试剂的经济角度考虑,试剂X最好是_______ ;氧化过程中铁、铬形成的离子均被氧化,则调pH时应将pH控制在_______ 范围内,单质铬与试剂Y反应时,反应中二者消耗量n(Cr):n(Y)=_______ 。
(3)设计实验检验废液中是否含有Fe3+:_______ 。
(4)已知常温下Ksp(CdCO3)=5.2×10-12,Ksp(CdS)=3.6×10-29。试剂Z是_______ (填“Na2CO3”或“Na2S”)时,Cd2+的去除效果较好。若用Na2S溶液处理CdCO3后,达到沉淀溶解平衡时溶液中c(S2-)=amol·L-1,则c( )=
)=_______ 。

几种金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 | Fe(OH)3 | Zn(OH)2 | Cd(OH)2 | Cr(OH)3 |
| 开始沉淀的pH | 1.5 | 8 | 7.2 | 6 |
| 沉淀完全的pH | 3.3 | 12 | 9.5 | 8 |
(1)写出提高酸浸速率的措施
(2)酸浸时形成的金属离子的价态均相同,料渣中含有大量的CoAs合金,写出除钴时反应的离子方程式
(3)设计实验检验废液中是否含有Fe3+:
(4)已知常温下Ksp(CdCO3)=5.2×10-12,Ksp(CdS)=3.6×10-29。试剂Z是
 )=
)=
您最近一年使用:0次



