【全国市级联考】山西省孝义市2018届高三下学期一模考试理综化学试题
山西
高三
一模
2018-04-30
385次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
【全国市级联考】山西省孝义市2018届高三下学期一模考试理综化学试题
山西
高三
一模
2018-04-30
385次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列说法正确的是
| A.太阳能电池利用光导纤维把太阳能转换为电能 |
| B.棉花、蚕丝所含元素相同,都属于高分子化合物 |
| C.人工分子筛( 多孔硅铝酸盐)可以用作吸附剂和催化剂 |
| D.硒是人体必需的微量元素,所以摄入越多越好 |
【知识点】 化学科学对人类文明发展的意义解读 人体健康基本维护 高分子材料
您最近一年使用:0次
2018-04-28更新
|
270次组卷
|
2卷引用:【全国市级联考】山西省孝义市2018届高三下学期一模考试理综化学试题
单选题
|
适中(0.65)
2. 设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.60g 二氧化硅晶体中含有NA个SiO2分子 |
| B.光照条件下,16 gCH4 与71g Cl2反应生成的CH3Cl 分子数为NA |
| C.1mol Li 在空气中充分燃烧生成Li2O,转移电子数为2NA |
| D.标准状况下,22.4 L NO 与NH3的混合气体中所含氮原子数为NA |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
3. 金刚烷及其衍生物在医药方面有很重要的用途。下列说法正确的是
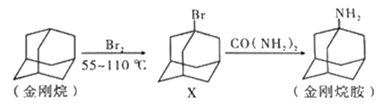

| A.X 的同分异构体只有两种 |
| B.金刚烷胺的分子式为C10H17N |
| C.金刚烷和环己烷属于同系物 |
| D.X转化为金刚烷胺的反应为加成反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
4. 熔融碳酸盐燃料电池(Molen Cathomale Fuel Cell)简称MCFC,具有高发电效率。工作原理示意图如图。下列说法正确的是
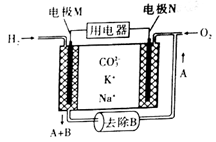

| A.电极M 为负极,K+、Na+移向M |
| B.电池工作时,熔融盐中CO32-物质的量增大 |
| C.A 为CO2,正极的电极反应为:O2+4e-+2CO2= 2CO32- |
| D.若用MCFC给铅蓄电池充电,电极N接Pb极 |
【知识点】 原电池电极反应式书写解读 燃料电池
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 短周期主族元素W、X、Y、Z原子序数依次增大,其中W的负一价阴离子W-能与水反应生成W2,Y、Z同主族,其原子L电子层的电子数比为3:4,X、Y、Z的最外层电子数之和为17。下列说法正确的是
| A.原子半径:W>X>Y | B.W、X、Y三者可形成离子化合物 |
| C.简单氢化物的沸点:Z>X>Y | D.W与X只能形成含有极性键的化合物 |
您最近一年使用:0次
2018-04-28更新
|
186次组卷
|
2卷引用:【全国市级联考】山西省孝义市2018届高三下学期一模考试理综化学试题
单选题
|
适中(0.65)
名校
解题方法
6. 根据下列实验中的操作,对应的现象以及结论都正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向NaAlO2溶液中滴加NaHCO3溶液 | 产生白色沉淀 |  结合H+的能力比 结合H+的能力比 强 强 |
| B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
| C | 将气体分别通入溴水和酸性高锰酸钾溶液中 | 两溶液均褪色 | 该气体一定是乙烯 |
| D | 炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中 | 有白色沉淀产生 | 有SO2和CO2产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-28更新
|
642次组卷
|
4卷引用:【全国市级联考】山西省孝义市2018届高三下学期一模考试理综化学试题
单选题
|
适中(0.65)
7. 298 K 时,向20 mL 0.01mol/LCH3COOH 溶液中逐滴加入0.01mol/L KOH 溶液,其pH变化曲线如图所示。下列叙述错误的是
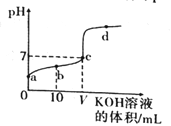

| A.a>2 |
B.醋酸的电离平衡常数:Ka= 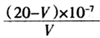 |
| C.b点溶液中:c(CH3COOH)+2c(H+) = c(CH3COO-) +2c(OH-) |
| D.a、b、c、d 四点溶液的导电性强弱顺序:d>c>b>a |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
解题方法
8. 三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3,PCl3、POCl3的部分性质如下:
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
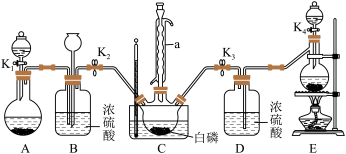
(1)仪器a 的名称为_______________ ,B装置中长颈漏斗的作用是___________________ 。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________ 。
(3)为使实验顺利进行,还需补充的装置为____________________ 。
(4)反应时,需严格控制三个条件:
①先制取___________ ,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是________ 。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________ (写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________ (写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
| 熔点/℃ | 沸点/℃ | 其他 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |

(1)仪器a 的名称为
(2)装置E用来制取Cl2,反应的离子方程式为
(3)为使实验顺利进行,还需补充的装置为
(4)反应时,需严格控制三个条件:
①先制取
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
9. 硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
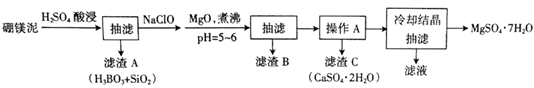
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________ (写出两条)。
(2)H2SO4 和Na2B4O7发生反应的化学方程式为________________ 。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________ 。
(4)加MgO煮沸,并调整溶液pH=5~6 的目的是_______________ 。
(5)已知MgSO4、CaSO4的溶解度如下表:
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________ ,__________________ 。
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________ 。
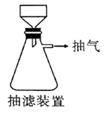
(7)实验中提供的硼镁泥共100 g,得到MgSO4·7H2O为172.2 g,则MgSO4·7H2O 的产率为__________ 。

已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有
(2)H2SO4 和Na2B4O7发生反应的化学方程式为
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为
(4)加MgO煮沸,并调整溶液pH=5~6 的目的是
(5)已知MgSO4、CaSO4的溶解度如下表:
 | 10℃ | 20℃ | 40℃ | 60℃ |
| MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
| CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是

(7)实验中提供的硼镁泥共100 g,得到MgSO4·7H2O为172.2 g,则MgSO4·7H2O 的产率为
您最近一年使用:0次
10. 甲醇和水蒸气制取H2 的反应如下:
反应Ⅰ(主):CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49 kJ/mol
CO2(g)+3H2(g) △H1=+49 kJ/mol
反应Ⅱ(副):H2(g)+CO2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CH3OH(g)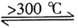 CO(g)+2H2(g) △H3=+90kJ/mol
CO(g)+2H2(g) △H3=+90kJ/mol
(1)△H2=_________ (填选项序号)。
(2)下列有关反应Ⅰ的说法不正确的是________ 。
a.恒温、恒压条件下,在反应体系中充入He,平衡不移动
b.恒温、恒容条件下,容器内的压强不发生变化反应达到平衡
c.反应达平衡时,H2的消耗速率是CO2 的消耗速率的3 倍
d.温度不变,减小压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动
(3)在一体积不变的密闭容器中,充入2.0 mol CH3OH(g)和1.0molH2O(g),达平衡后,再加入1.0mol CH3OH(g)和0.5mol H2O(g),在相同温度下,再达平衡时,甲醇的转化率______ (填“增大”“ 减小”或“不变”)。
(4)催化剂不仅可以改变化学反应速率,还有一种特性叫“催化剂的选择性”。下图为某催化剂作用下,CH3OH 转化率、CO生成率与温度的变化关系。
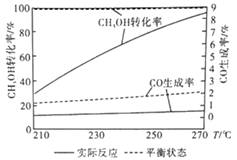
①随着温度的升高,CO的实际反应生成率与平衡状态生成率相差较大的原因是催化剂对_____________ (填“反应Ⅰ”或“反应Ⅱ”)的选择性低。
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是___________ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_______________ 。
(5)250℃,一定压强和催化剂条件下,在1L的容器中1.00mol CH3OH 和1.32 mol H2O充分反应(忽略反应Ⅲ),平衡时测得H2 为2.70mol,CO为0.030mol,H2O为0.44mol,列式计算反应Ⅱ的平衡常数K=___________ (结果保留两位有效数字)。
反应Ⅰ(主):CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H1=+49 kJ/mol
CO2(g)+3H2(g) △H1=+49 kJ/mol反应Ⅱ(副):H2(g)+CO2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CH3OH(g)
 CO(g)+2H2(g) △H3=+90kJ/mol
CO(g)+2H2(g) △H3=+90kJ/mol(1)△H2=
(2)下列有关反应Ⅰ的说法不正确的是
a.恒温、恒压条件下,在反应体系中充入He,平衡不移动
b.恒温、恒容条件下,容器内的压强不发生变化反应达到平衡
c.反应达平衡时,H2的消耗速率是CO2 的消耗速率的3 倍
d.温度不变,减小压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动
(3)在一体积不变的密闭容器中,充入2.0 mol CH3OH(g)和1.0molH2O(g),达平衡后,再加入1.0mol CH3OH(g)和0.5mol H2O(g),在相同温度下,再达平衡时,甲醇的转化率
(4)催化剂不仅可以改变化学反应速率,还有一种特性叫“催化剂的选择性”。下图为某催化剂作用下,CH3OH 转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率与平衡状态生成率相差较大的原因是催化剂对
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(5)250℃,一定压强和催化剂条件下,在1L的容器中1.00mol CH3OH 和1.32 mol H2O充分反应(忽略反应Ⅲ),平衡时测得H2 为2.70mol,CO为0.030mol,H2O为0.44mol,列式计算反应Ⅱ的平衡常数K=
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
11. [化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________ 。
(2)下列各项比较中,Mg>Al的是____________ (填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。
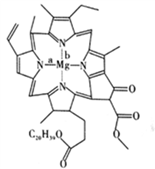
①Mg2+与N原子形成的化学键为配位键的是__________ (填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________ 。
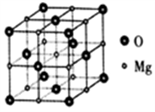
(4)MgO具有NaCl 型结构(如图),MgO晶体的熔点比NaCl 高的原因是________________ ;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________ ,r(O2-)=0.148mm,MgO的密度为___________ g/cm3(NA表示阿伏伽德罗常数的值,列出计算式)。
(1)基态Mn2+核外电子排布式为
(2)下列各项比较中,Mg>Al的是
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。

①Mg2+与N原子形成的化学键为配位键的是
②叶绿素分子中C原子的杂化轨道类型有
(4)MgO具有NaCl 型结构(如图),MgO晶体的熔点比NaCl 高的原因是

您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
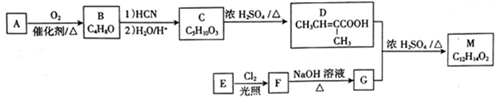
12. [化学-选修5:有机化学基础]化合物M 是合成香精的重要原料。实验室由A 和芳香烃E制备M 的一种合成路线如下:
已知: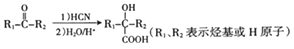
请回答下列问题:
(1)A 的化学名称为___________ ,F 的结构简式为______________ 。
(2)B 中官能团的名称为______________ 。
(3)F→G的反应类型为__________________ 。
(4)D+G→M 的化学方程式为_________________ 。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________ 。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以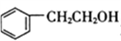 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备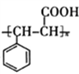 的合成路线
的合成路线______________________ 。

已知:
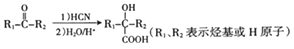
请回答下列问题:
(1)A 的化学名称为
(2)B 中官能团的名称为
(3)F→G的反应类型为
(4)D+G→M 的化学方程式为
(5)写出同时满足下列条件的D的同分异构体的结构简式
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以
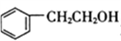 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线
的合成路线
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学科学对人类文明发展的意义 人体健康基本维护 高分子材料 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 | |
| 3 | 0.65 | 烷烃结构与性质的关系 多官能团有机物的结构与性质 有机推断综合考查 | |
| 4 | 0.65 | 原电池电极反应式书写 燃料电池 | |
| 5 | 0.65 | 微粒半径大小的比较方法 根据原子结构进行元素种类推断 化学键与物质类别关系的判断 | |
| 6 | 0.65 | 氨水 二氧化硫 铝三角转化 乙烯 | |
| 7 | 0.65 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.4 | 氯气的实验室制法 酸碱中和滴定原理的应用 常见无机物的制备 物质含量的测定 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 物质分离、提纯综合应用 常见无机物的制备 物质含量的测定 | 工业流程题 |
| 10 | 0.65 | 盖斯定律与热化学方程式 温度对化学反应速率的影响 化学平衡的移动及其影响因素 化学平衡题中基于图表数据的相关计算 | 原理综合题 |
| 11 | 0.65 | 物质结构与性质综合考查 简单配合物的成键 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 羧酸酯化反应 根据题给物质选择合适合成路线 有机合成综合考查 有机推断综合考查 | 有机推断题 |



