名校
解题方法
1 . 电石(主要成分为 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
(1)碳元素在元素周期表中的位置为_______ ; 的电子式为
的电子式为_______ 。
(2)①目前工业上合成电石主要采用氧热法。
已知: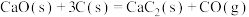
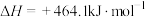 ;
;

 。
。
若不考虑热量耗散,物料转化率均为 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产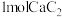 ,投料的量为
,投料的量为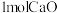 、
、_______ 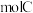 及
及_______ 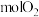 。
。
②制乙炔后的固体废渣主要成分为 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为_______ 。
(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:
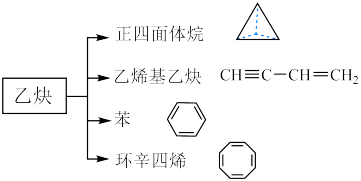
下列说法正确的是_______(填标号)。
(4)以乙炔为原料可制备维尼纶(PVAC),其合成路线如下:
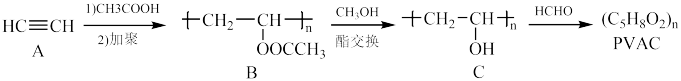
① 中官能团名称为
中官能团名称为_______ 。
② 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为_______ 。
③ 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为_______ 。
 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:(1)碳元素在元素周期表中的位置为
 的电子式为
的电子式为(2)①目前工业上合成电石主要采用氧热法。
已知:
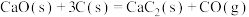
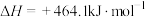 ;
;
 。
。若不考虑热量耗散,物料转化率均为
 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产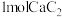 ,投料的量为
,投料的量为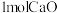 、
、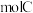 及
及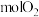 。
。②制乙炔后的固体废渣主要成分为
 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:

下列说法正确的是_______(填标号)。
| A.乙烯基乙炔分子中所有原子可以处于同一直线上 |
B.常温下, 苯中含碳碳双键数目约为 苯中含碳碳双键数目约为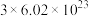 |
| C.环辛四烯与苯均能使酸性高锰酸钾溶液褪色 |
| D.正四面体烷与环辛四烯的一取代物均只有一种 |
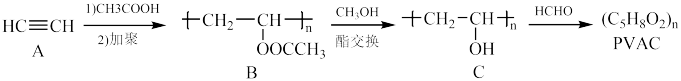
①
 中官能团名称为
中官能团名称为②
 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为③
 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为
您最近一年使用:0次
名校
2 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
239次组卷
|
2卷引用:四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题
名校
3 . 电镀污泥(主要含Cr、Cu、Zn、Ni、Fe、Si)中金属大多以氢氧化物的形式存在,硅以SiO2形式存在。某科研团队用萃取——沉淀法回收电镀污泥中金属的技术路线如图所示。
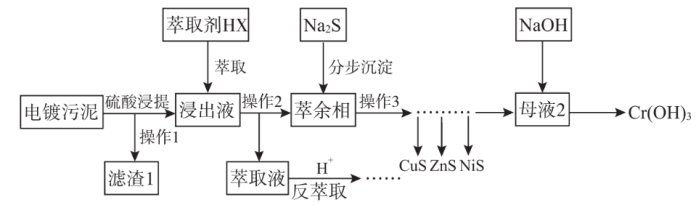
已知:①萃取反应可简单表示为nHX+Mn+ MXn+nH+
MXn+nH+
②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为___ ;滤渣1的主要成分是___ 。
(2)操作2的名称为___ 。
(3)萃取浸出液除去的元素为___ (填元素符号),由于该元素在分步沉淀工序中与硫化钠发生氧化还原反应生成多种沉淀难以分离,故该元素不可在分步沉淀工序中除去,写出此反应的化学方程式___ 。
(4)反萃取工序发生的离子方程式为____ 。
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为___ [通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全,Ksp(NiS)=1×10-19,考虑H2S的二级电离Ka1(H2S)=1×10-7,Ka2(H2S)=1×10-15]。

已知:①萃取反应可简单表示为nHX+Mn+
 MXn+nH+
MXn+nH+②相关资料显示,分步沉淀工序中投加硫化钠生成沉淀时,可以认为水溶液中的H2S饱和,饱和c(H2S)=1.0mol·L-1。
回答下列问题:
(1)铁元素在元素周期表中位置为
(2)操作2的名称为
(3)萃取浸出液除去的元素为
(4)反萃取工序发生的离子方程式为
(5)萃余相中的Ni元素恰好完全转化为沉淀的pH为
您最近一年使用:0次
2021-09-23更新
|
278次组卷
|
2卷引用:河北省省级联测2021-2022学年高三上学期第一次考试化学试题
2022高三·全国·专题练习
4 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中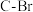 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: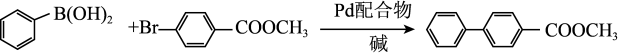
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
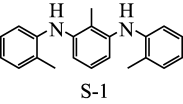
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中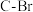 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
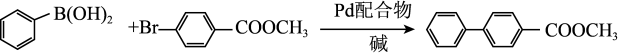
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
8920次组卷
|
15卷引用:湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题
湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
解题方法
5 . 部分短周期元素的原子序数与主要化合价的关系如图所示:

请回答下列问题:
(1)元素a~j中非金属性最强的是_______ (填元素符号),元素i在元素周期表中的位置为_______ ,j的原子结构示意图为_______ 。
(2)b、d、e、j四种元素的简单离子半径的大小顺序为_______ (填元素符号)。
(3)元素e与j形成化合物,其电子式为_______ ,所含化学键的类型为_______ 。
(4)b的同主族元素碲(Te)与碘元素同周期,下列有关说法正确的是_______
(5)f元素的氧化物与氢氧化钠溶液反应的离子方程式为_______ 。

请回答下列问题:
(1)元素a~j中非金属性最强的是
(2)b、d、e、j四种元素的简单离子半径的大小顺序为
(3)元素e与j形成化合物,其电子式为
(4)b的同主族元素碲(Te)与碘元素同周期,下列有关说法正确的是_______
| A.单质碲在常温下是液体 | B.酸性: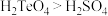 |
C.稳定性: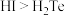 | D.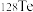 和 和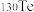 互为同位素 互为同位素 |
您最近一年使用:0次
解题方法
6 . 元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系;运用元素周期律研究元素及其化合物的性质具有重要的意义。

上图为元素周期表的一部分,根据表中给出的9种元素,回答下列问题:
(1)元素⑦在周期表中的位置为第_______ 周期第_______ 族,其氧化物属于_______ (填“酸性”“碱性”或“两性”)氧化物。
(2)周期表所给九种元素中原子半径最大的元素是_______ (填元素名称);最高价含氧酸酸性最强的是_______ (填化学式)。
(3)写出元素⑥的单质与元素④的最高价氧化物对应水化物反应的离子方程式:_______ 。
(4)元素③⑦⑧形成简单氢化物的稳定性:_______ >_______ >_______ (填化学式)。
(5)由元素①④⑧形成的化合物属于_______ (填“离子”或“共价”)化合物,该化合物中含有的化学键类型有_______ 。
(6)下列不能说明⑤⑥两种元素金属性相对强弱的是_______(填字母)。

上图为元素周期表的一部分,根据表中给出的9种元素,回答下列问题:
(1)元素⑦在周期表中的位置为第
(2)周期表所给九种元素中原子半径最大的元素是
(3)写出元素⑥的单质与元素④的最高价氧化物对应水化物反应的离子方程式:
(4)元素③⑦⑧形成简单氢化物的稳定性:
(5)由元素①④⑧形成的化合物属于
(6)下列不能说明⑤⑥两种元素金属性相对强弱的是_______(填字母)。
| A.⑤的氧化物是碱性氧化物,⑥的氧化物是两性氧化物 |
| B.最高价氧化物对应水化物碱性:⑤>⑥ |
| C.与同浓度的盐酸反应,⑤的单质比⑥剧烈 |
D.⑤和⑥均可以从 溶液中置换出铜单质 溶液中置换出铜单质 |
您最近一年使用:0次
名校
7 . (一)如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
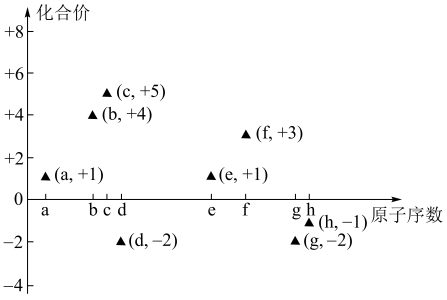
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式_____ ,乙分子类型属于____ 分子(填“极性”或“非极性”)。
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为_____ ,如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称_____ 。
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为_____ ,f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为_____ 。
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置_____ ,其价电子排布图为____ 。
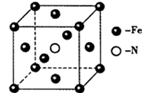
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为______ 。若该晶体的密度是ρg•cm-3,则两个最近的Fe原子间的距离为_____ cm。(用NA表示阿伏加德罗常数的值)
(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()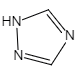 。
。
①配合物中阴离子的空间构型为_____ ,中心原子的杂化方式是_____ 。
② 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为______ 。
③1摩尔1,2,4—三氮唑最多能与_____ molH+结合。
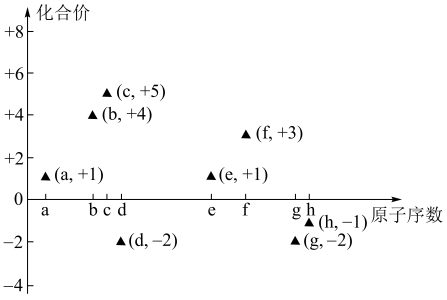
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为

(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()
 。
。①配合物中阴离子的空间构型为
②
 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为③1摩尔1,2,4—三氮唑最多能与
您最近一年使用:0次
2022-01-13更新
|
161次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高一下学期开学化学试题
名校
8 . 我国提出努力争取在2060年前实现“碳中和”,充分体现了解决气候问题的大国担当。“筑梦”活动小组开展了“低碳有我“实践活动,请回答下列问题。
【活动一】调查碳循环
(1)观察图1,自然界中消耗二氧化碳的途径有___________ (写一条即可)。

(2)基于“碳循环”视角,实现“碳中和”可以从两方面进行:①减少碳排放 ②___________ 。
(3)调查发现,我国的碳排放80%以上来自能源使用。要减少能源使用对大气中二氧化碳含量的影响,下列措施不可行的是___________ (选填字母序号)。
A.严禁使用化石燃料
B.改进技术,提高能效
C.捕集能源使用过程中生成的二氧化碳,进行封存处理
【活动二】探究碳“捕捉”
根据二氧化碳的性质,可以用水和碱溶液“捕捉”二氧化碳。为比较“捕捉”效果,小组同学设计如图2所示实验,装置a端连接气压传感器,测得烧瓶内压强与时间的关系曲线如图3所示。

(4)图2中,甲、乙、丙注射器内的试剂分别是水、饱和石灰水、氢氧化钠浓溶液,X的数值为___________ ;分析图3可知“捕捉“二氧化碳效果最好的是___________ (选填装置序号),该装置中发生反应的化学方程式为___________ 。
(5)“碳封存”技术也是实现“碳中和”的重要途径之一、某实验基地通过一定技术将二氧化碳压缩存入地下,实现二氧化碳的封存。从微观角度分析,这一技术能够实现的原因是___________ 。
【活动三】计算碳转化
(6)基于元素守恒,小组同学推测可以将二氧化碳转化为更高价值的物质,实现二氧化碳的再利用。我国科学家在利用二氧化碳直接合成乙醇 的研究上已取得重大突破,其转化的化学方程式为2CO2+6R
的研究上已取得重大突破,其转化的化学方程式为2CO2+6R C2H5OH+3H2O,其中R的化学式为
C2H5OH+3H2O,其中R的化学式为___________ 。
(7)如果用此方法处理44kg二氧化碳,使其完全反应,请根据化学方程式计算生成乙醇的质量___________ (写出计算过程)。
【活动四】聚力助低碳
(8)实现“碳中和”需要世界各国的共同关注和努力。中国已积极采取多种措施,如调整能源结构,开发使用新能源等,请写出一种新能源________ 。青少年也应积极助力低碳,你的做法是_________ (写一条即可)。
【活动一】调查碳循环
(1)观察图1,自然界中消耗二氧化碳的途径有

(2)基于“碳循环”视角,实现“碳中和”可以从两方面进行:①减少碳排放 ②
(3)调查发现,我国的碳排放80%以上来自能源使用。要减少能源使用对大气中二氧化碳含量的影响,下列措施不可行的是
A.严禁使用化石燃料
B.改进技术,提高能效
C.捕集能源使用过程中生成的二氧化碳,进行封存处理
【活动二】探究碳“捕捉”
根据二氧化碳的性质,可以用水和碱溶液“捕捉”二氧化碳。为比较“捕捉”效果,小组同学设计如图2所示实验,装置a端连接气压传感器,测得烧瓶内压强与时间的关系曲线如图3所示。

(4)图2中,甲、乙、丙注射器内的试剂分别是水、饱和石灰水、氢氧化钠浓溶液,X的数值为
(5)“碳封存”技术也是实现“碳中和”的重要途径之一、某实验基地通过一定技术将二氧化碳压缩存入地下,实现二氧化碳的封存。从微观角度分析,这一技术能够实现的原因是
【活动三】计算碳转化
(6)基于元素守恒,小组同学推测可以将二氧化碳转化为更高价值的物质,实现二氧化碳的再利用。我国科学家在利用二氧化碳直接合成乙醇
 的研究上已取得重大突破,其转化的化学方程式为2CO2+6R
的研究上已取得重大突破,其转化的化学方程式为2CO2+6R C2H5OH+3H2O,其中R的化学式为
C2H5OH+3H2O,其中R的化学式为(7)如果用此方法处理44kg二氧化碳,使其完全反应,请根据化学方程式计算生成乙醇的质量
【活动四】聚力助低碳
(8)实现“碳中和”需要世界各国的共同关注和努力。中国已积极采取多种措施,如调整能源结构,开发使用新能源等,请写出一种新能源
您最近一年使用:0次



