1 . 有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
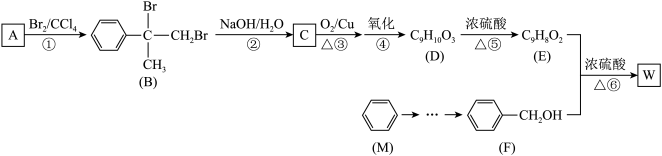
已知: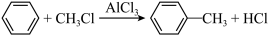
请回答下列问题:
(1)F的化学名称是__ ,②的反应类型是___ 。
(2)D中含有的官能团是__ (写名称),D聚合生成高分子化合物的结构简式为___ 。
(3)反应③的化学方程式是___ 。
(4)反应⑥的化学方程式是___ 。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___ 。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)___ 。
[示例:CH3CH2OH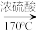 CH2=CH2
CH2=CH2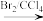 BrCH2CH2Br]
BrCH2CH2Br]

已知:
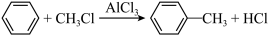
请回答下列问题:
(1)F的化学名称是
(2)D中含有的官能团是
(3)反应③的化学方程式是
(4)反应⑥的化学方程式是
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)
[示例:CH3CH2OH
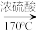 CH2=CH2
CH2=CH2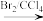 BrCH2CH2Br]
BrCH2CH2Br]
您最近一年使用:0次
2019-12-24更新
|
1187次组卷
|
3卷引用:上海市民星中学2018—2019学年高三上学期期中考试化学试题
14-15高三上·上海宝山·阶段练习
名校
解题方法
2 . 某化工厂以甲烷为原料合成甲醇的反应为:(所有气体体积均已折算为标准状况)
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为 )
)
(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=________________ ,n(H2)=__________________ 。
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=________ ;
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)________________
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为
 )
)(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)
您最近一年使用:0次
3 . 氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______ (小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________ 上表中x=________ m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)
您最近一年使用:0次
2012·上海·零模
解题方法
4 . 某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
 ①(反应中CH4转化率为1)
①(反应中CH4转化率为1)
 ②(反应中CH4转化率为1)
②(反应中CH4转化率为1)
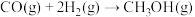 (反应中CO转化率为
(反应中CO转化率为 )
)
合成工艺如下:
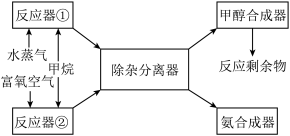
请回答下列问题(所有气体体积均折算为标准状况):
(1)若只用反应器①来直接合成甲醇。当充入反应器①的甲烷和水蒸气的体积分别为672m3和2240m3时,反应剩余物中CO为_____ mol、H2为_______ mol;
(2)若CH4同时和H2O(g)及O2(g)反应,则am3 CH4按上述两式完全反应,产物气体的体积V的范围为________ 。
(3)若充入反应器①的甲烷和水蒸气的体积分别为l体积和3体积,反应剩余物中: V(H2):V(N2):V(CO)=3:1:l。则充入反应器②的富氧空气(只含N2和H2)的体积为_______ ;富氧空气中氧气体积分数为____ 。
(4)若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2):n(N2)=3:1,来合成氨气,则反应中的H2O(g)富氧空气的物质的量之比为_______ 。
 ①(反应中CH4转化率为1)
①(反应中CH4转化率为1) ②(反应中CH4转化率为1)
②(反应中CH4转化率为1)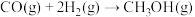 (反应中CO转化率为
(反应中CO转化率为 )
)合成工艺如下:

请回答下列问题(所有气体体积均折算为标准状况):
(1)若只用反应器①来直接合成甲醇。当充入反应器①的甲烷和水蒸气的体积分别为672m3和2240m3时,反应剩余物中CO为
(2)若CH4同时和H2O(g)及O2(g)反应,则am3 CH4按上述两式完全反应,产物气体的体积V的范围为
(3)若充入反应器①的甲烷和水蒸气的体积分别为l体积和3体积,反应剩余物中: V(H2):V(N2):V(CO)=3:1:l。则充入反应器②的富氧空气(只含N2和H2)的体积为
(4)若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2):n(N2)=3:1,来合成氨气,则反应中的H2O(g)富氧空气的物质的量之比为
您最近一年使用:0次
5 . 以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油。(流程示意图如下,反应③的H2也由反应①得到。)
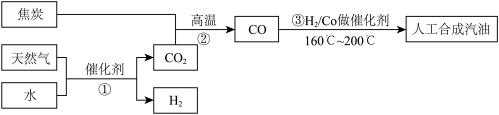
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品_______________ 。
(2)当CO2的使用量应控制为反应①中CO2产量的______________ (填比例范围),可以得到理想的产品。

若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品
(2)当CO2的使用量应控制为反应①中CO2产量的
您最近一年使用:0次
解题方法
6 . 已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃).
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式_______ (需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的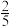 ,通过计算说明是否生成汽油
,通过计算说明是否生成汽油______________________ .
(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)
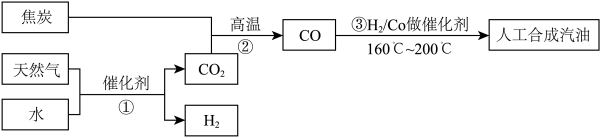
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品________________ .
(b)当CO2的使用量应控制为反应①中CO2产量的_____ (填比例范围),可以得到理想的产品.
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的
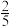 ,通过计算说明是否生成汽油
,通过计算说明是否生成汽油(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)

若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品
(b)当CO2的使用量应控制为反应①中CO2产量的
您最近一年使用:0次
2010·上海·零模
7 . CO和CO2都可以合成甲醇:CO+2H2→CH3OH;CO2+3H2→CH3OH+H2O,CO、CO2和H2可通过下列反应制备:①CH4+H2O(g) →CO+3H2 ;②CO+H2O(g) →CO2+H2;反应①的产物合成甲醇时H2过量,反应②的的产物合成甲醇时H2不足。为了充分利用原料,可将两个反应的产物混合使用。
(1)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体以合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为__________ 。
(2)若以100L CH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,在相同条件下反应后气体的体积为______________ L(写范围)。
(3)若以100L CH4和H2O的混合气体,充分反应后,测得同温同压下气体的体积为180L,求原混合气体中CH4和H2O的体积比为__________ 。
(4)在100L CH4和H2O的混合气体中,CH4所占的体积分数为x,反应后气体的体积为y(L),求:x的取值范围和气体产物的体积y(用含x的函数表达式)__________
(1)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体以合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为
(2)若以100L CH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,在相同条件下反应后气体的体积为
(3)若以100L CH4和H2O的混合气体,充分反应后,测得同温同压下气体的体积为180L,求原混合气体中CH4和H2O的体积比为
(4)在100L CH4和H2O的混合气体中,CH4所占的体积分数为x,反应后气体的体积为y(L),求:x的取值范围和气体产物的体积y(用含x的函数表达式)
您最近一年使用:0次
真题
解题方法
8 . CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_______ L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______ 。
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少_______ ?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2 CH3OH,CO2+3H2
CH3OH,CO2+3H2 CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______ 。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O
 CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2 CH3OH,CO2+3H2
CH3OH,CO2+3H2 CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
您最近一年使用:0次
2016-12-09更新
|
296次组卷
|
6卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
2016年全国普通高等学校招生统一考试化学(上海卷精编版)2016年全国普通高等学校招生统一考试化学(上海卷参考版)人教版2017届高三单元精练检测一化学试题(已下线)2019年高考化学一轮复习讲练测1.2 物质的量浓度 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)
9 . 工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________ ,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______ (保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________ m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________ 。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
您最近一年使用:0次
2015-06-02更新
|
418次组卷
|
2卷引用:2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷
10 . 纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C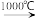 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3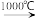 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________ kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________ 。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________ kg,此时消耗碳单质的量是原步骤②反应用碳量的____ 倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。__________
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
____
2NaCl+H2SO4
 Na2SO4+2HCl↑
Na2SO4+2HCl↑Na2SO4+2C
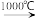 Na2S+2CO2↑
Na2S+2CO2↑Na2S+CaCO3
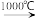 Na2CO3+CaS
Na2CO3+CaS完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
| x | y | z |
您最近一年使用:0次



