名校
1 . 食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答.
(1)聚偏二氯乙烯(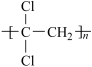 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由___________ (写结构简式) 单体发生加聚反应生成的.若以乙炔为原料,通过加成反应生成1,1,2三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在加成反应中宜选择的试剂是_________ .(选填编号字母)
a.HCl b.Cl2 c.HClO d.NaCl
(2)人们从食用植物油中摄取的亚油酸[ ]对人体健康是十分有益的,然而市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是___________ (选填编号字母).
a.分子式为C18H34O2
b.在食用油中亚油酸通常是以甘油酯的形式存在
c.亚油酸属于一种不饱和低级脂肪酸,所以能和NaOH溶液反应
d.亚油酸含量高的植物油在空气中易氧化变质
(3)食用酱油中的“氯丙醇”是多种氯代丙醇的总称,它们是在酱油配制过程中植物蛋白水解发生一系列化学变化而产生的,氯丙醇中部分异构体对人体有不同程度的致癌效应.则氯丙醇中三氯丙醇异构体共有_________ 种(已知卤原子和羟基一般不会连在同一碳原子上).
(4)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖,请设计实验证明淀粉已经全部水解,写出操作方法、现象和结论______________ .
(5)木糖醇[CH2OH(CHOH)3CH2OH]作为一种甜味剂,食用后不会引起血糖升高,比较适合于糖尿病人食用.预测木糖醇能和新制备的Cu(OH)2浊液发生化学反应的依据是___________ .
(6)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得A的相对分子质量为60.
②对A的水溶液进行测定发现该溶液pH<7.
③核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值,根据峰值可以确定分子中氢原子的种类和数目.例如乙醇有三种氢原子(图1).经测定有机物A的核磁共振氢谱示意图如图2
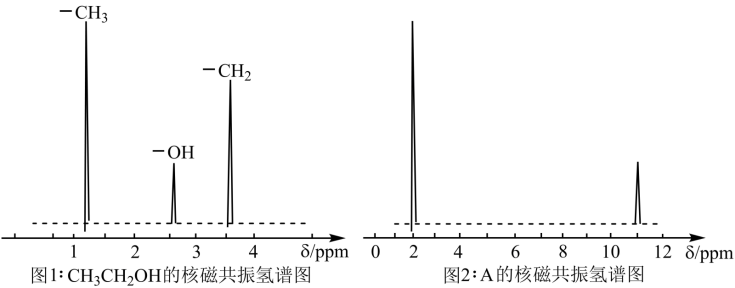
根据以上分析,写出A的结构简式__________ .
(1)聚偏二氯乙烯(
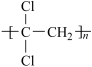 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由a.HCl b.Cl2 c.HClO d.NaCl
(2)人们从食用植物油中摄取的亚油酸[
 ]对人体健康是十分有益的,然而市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是a.分子式为C18H34O2
b.在食用油中亚油酸通常是以甘油酯的形式存在
c.亚油酸属于一种不饱和低级脂肪酸,所以能和NaOH溶液反应
d.亚油酸含量高的植物油在空气中易氧化变质
(3)食用酱油中的“氯丙醇”是多种氯代丙醇的总称,它们是在酱油配制过程中植物蛋白水解发生一系列化学变化而产生的,氯丙醇中部分异构体对人体有不同程度的致癌效应.则氯丙醇中三氯丙醇异构体共有
(4)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖,请设计实验证明淀粉已经全部水解,写出操作方法、现象和结论
(5)木糖醇[CH2OH(CHOH)3CH2OH]作为一种甜味剂,食用后不会引起血糖升高,比较适合于糖尿病人食用.预测木糖醇能和新制备的Cu(OH)2浊液发生化学反应的依据是
(6)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得A的相对分子质量为60.
②对A的水溶液进行测定发现该溶液pH<7.
③核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值,根据峰值可以确定分子中氢原子的种类和数目.例如乙醇有三种氢原子(图1).经测定有机物A的核磁共振氢谱示意图如图2

根据以上分析,写出A的结构简式
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.实验室有一瓶失去标签的某白色固体X,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且成分单一。现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定
实验方法及现象:__ 。
结论:此白色固体是钠盐。
(2)阴离子的确定
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需继续进行如下实验:取适量白色固体配成溶液,取少许该溶液于试管中,加入BaCl2溶液,出现白色沉淀。
结论:__ 。
Ⅱ.确认其成分后,由于某些原因,该白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤①:称取样品1.000g。
步骤②:将样品溶解后完全转移到250mL容量瓶中,定容,充分摇匀。
步骤③:移取25.00mL样品溶液于250mL锥形瓶中,用0.01mol·L-1KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤③所发生反应的离子方程式:__ 。
(2)判断滴定终点的现象是__ 。
(3)在配制0.01mol·L-1KMnO4溶液定容时若仰视,则最终测得变质固体中X的含量__ (填“偏大”、“偏小”或“无影响”)。
(4)滴定结果如表所示:
则该变质固体中X的质量分数为___ 。
(1)阳离子的确定
实验方法及现象:
结论:此白色固体是钠盐。
(2)阴离子的确定
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需继续进行如下实验:取适量白色固体配成溶液,取少许该溶液于试管中,加入BaCl2溶液,出现白色沉淀。
结论:
Ⅱ.确认其成分后,由于某些原因,该白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤①:称取样品1.000g。
步骤②:将样品溶解后完全转移到250mL容量瓶中,定容,充分摇匀。
步骤③:移取25.00mL样品溶液于250mL锥形瓶中,用0.01mol·L-1KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤③所发生反应的离子方程式:
(2)判断滴定终点的现象是
(3)在配制0.01mol·L-1KMnO4溶液定容时若仰视,则最终测得变质固体中X的含量
(4)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
您最近一年使用:0次
3 . 下列实验操作及现象,能推出相应结论的是
| 选项 | 实验操作及现象 | 结论 |
| A | 常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大 | 酸性:CH3COOH>HClO |
| B | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生 | 淀粉没有水解 |
| C | 向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| D | 向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于稀硫酸前已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-15更新
|
404次组卷
|
3卷引用:青海省西宁市2018届高三下学期复习检测一(一模)理综化学试题
名校
4 . 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________ ;装置D中反应生成NaClO2的化学方程式为________________________ ;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________ ;检验该离子的方法是________________________ ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________ ;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________ ;
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________ (填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________ 。
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。

(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
5 . 电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
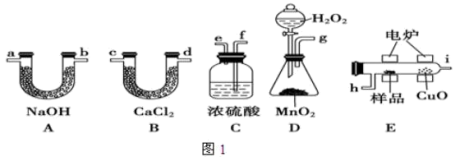
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是__________________
(2)C装置中浓硫酸的作用是________________ .
(3)D装置中MnO2的作用是________________________ .
(4)燃烧管中CuO的作用是________________ .
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为______ .
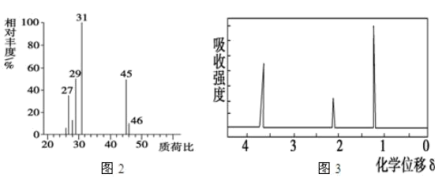
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为____ .
(7)能否根据A的实验式确定A的分子式________ (填“能”或“不能”),若能,则A的分子式是______ (若不能,则此空不填).
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为________ .


(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为
(7)能否根据A的实验式确定A的分子式
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为
您最近一年使用:0次
2016-12-09更新
|
176次组卷
|
2卷引用:2015-2016学年青海西宁第四高级中学高二下期末化学卷



