解题方法
1 . 漂白粉的主要成分是次氯酸钙和氯化钙。请回答下列问题:
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):____________________________ 。
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为_____________ (假设漂白粉中的其它成份不与硝酸反应)。
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
您最近一年使用:0次
名校
2 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉部分变质 |
您最近一年使用:0次
2021-04-07更新
|
1029次组卷
|
16卷引用:天津市和平区2017-2018学年高一上学期期末考试化学试题
天津市和平区2017-2018学年高一上学期期末考试化学试题安徽省芜湖市第一中学2020-2021学年高一上学期第二次月考化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题浙江省余姚中学2020-2021 学年高一上学期期中考试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题辽宁省沈阳市2020-2021学年高一上学期期末质量监测化学试题山西省怀仁市2020-2021学年高一上学期期末考试化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题(已下线)专题六 铁及其化合物(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题人教2019版必修第一册第三章 铁 金属材料复习与提高河南省洛阳市2021-2022学年高一上学期期末考试化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题安徽省芜湖市2022-2023学年高一上学期期末教学质量统测化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后
名校
解题方法
3 . 根据下列实验操作和现象所得结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 在小烧杯中滴有少量水,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,用玻璃棒快速搅拌并触摸烧杯外壁,发现烧杯外壁很冷 | Ba(OH)2·8H2O与NH4Cl的反应为吸热反应 |
| B | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | Fe(NO3)2已变质 |
| C | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| D | 向5mL0.1mol·L-1FeCl3溶液中滴入0.1 mol·L-1KI溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,溶液变红 | Fe3+与I-的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-03更新
|
1304次组卷
|
4卷引用:江苏省苏州市2019-2020学年高一下学期期末考试化学试题
名校
解题方法
4 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置中发生反应的化学方程式。
①装置A:_______
②装置B:_______
③装置C:_______
④装置D:_______ 。
(2)D中NaOH溶液的作用是_______ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顾序为_______ 。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置中发生反应的化学方程式。
①装置A:
②装置B:
③装置C:
④装置D:
(2)D中NaOH溶液的作用是
(3)为准确读出氧气的体积需进行以下操作,正确的顾序为
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
5 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并设计如图装置来测定过氧化钠的质量分数。
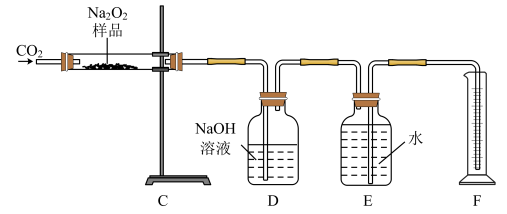
①将仪器连接好以后,必须进行的第一步操作是________________ 。
②装置D的作用是________________________________________ 。
③写出装置C中发生主要反应的化学方程式________________________ 。
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是________ (填字母)。
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成氧气的质量为ag,则样品中过氧化钠的质量分数为________ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并设计如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②装置D的作用是
③写出装置C中发生主要反应的化学方程式
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成氧气的质量为ag,则样品中过氧化钠的质量分数为
您最近一年使用:0次
6 . 由下列操作与现象推出的相应结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 光束通过蛋白质溶液 | 产生光亮通路 | 蛋白质溶液属于胶体 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已变质 |
| C | 向某溶液中加入盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有SO42﹣ |
| D | 测定0.1mol•L﹣1和0.01mol•L﹣1的醋酸溶液导电性 | 前者导电性更强 | 浓度越大,醋酸电离程度越大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-06更新
|
287次组卷
|
3卷引用:河北省张家口市第一中学2021届高三上学期期中考试(衔接班)化学试题
名校
解题方法
7 . 下列实验操作能达到实验目的的是
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-24更新
|
624次组卷
|
8卷引用:山东省聊城市2020-2021学年高二上学期期中考试化学试题
名校
8 . 过氧化钠常用作漂白剂、杀菌消毒剂,能与水和二氧化碳等物质发生反应,保存不当容易变质。某兴趣小组以过氧化钠为对象进行如下探究:
探究一: “干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应”,设计如下实验装置:
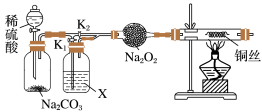
(1)连接装置,检查气密性。在干燥管中装入Na2O2后,打开活塞加入稀硫酸,生成CO2。打开K1,关闭K2,一段时间后再加热铜丝。其中,X中应加入试剂_____________ (填名称)。先通一段时间CO2的目的是____________________________________ ,实验观察到铜丝未变化,则得出结论“干燥的CO2不能与Na2O2反应”。
(2)若打开K2,关闭K1,出现_____________________________ 现象,可证明“有水时CO2与Na2O2反应”产生了O2。
探究二:Na2O2是否已经变质并粗略测定该样品中Na2O2的质量分数
(3)乙同学为粗略测定该样品中Na2O2的质量分数,称取m g样品,设计如下装置进行实验:
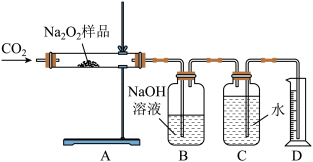
实验开始后,A中发生反应的化学方程式为:______________________________ ;利用装置B除去混合气体未反应的CO2;调整装置C、D内液面高度相同,读出量筒D中水的体积,并将其折算成氧气的质量为n g。则该样品中Na2O2的质量分数为:____________________________ 。
探究一: “干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应”,设计如下实验装置:

(1)连接装置,检查气密性。在干燥管中装入Na2O2后,打开活塞加入稀硫酸,生成CO2。打开K1,关闭K2,一段时间后再加热铜丝。其中,X中应加入试剂
(2)若打开K2,关闭K1,出现
探究二:Na2O2是否已经变质并粗略测定该样品中Na2O2的质量分数
(3)乙同学为粗略测定该样品中Na2O2的质量分数,称取m g样品,设计如下装置进行实验:

实验开始后,A中发生反应的化学方程式为:
您最近一年使用:0次
名校
9 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
548次组卷
|
5卷引用:河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2
河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)
名校
解题方法
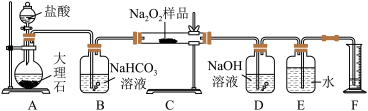
10 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_____ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
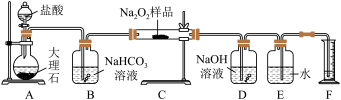
①A中发生反应离子方程式为___________ 。
②将仪器连接好以后,必须进行的第一步操作是________ 。
③B装置出来的气体是否需要干燥____________ 。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式__________ 。
⑤D中NaOH溶液的作用___________ 。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是______ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为_____________ 。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③B装置出来的气体是否需要干燥
④写出装置C中发生的所有反应的化学方程式
⑤D中NaOH溶液的作用
⑥实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
2020-09-04更新
|
115次组卷
|
2卷引用:河北省张家口市第一中学2021届高三上学期期中考试(普通、实验班)化学试题



