1 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
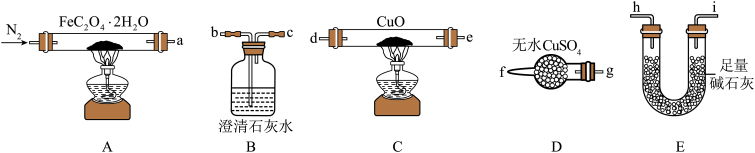
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
2020-06-12更新
|
1222次组卷
|
3卷引用:吉林省延边州2020届高三4月教学质量检测理科综合化学试题
2018·江西南昌·模拟预测
名校
2 . 下列说法正确的是( )
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3 |
| C.将Fe(NO3)3样品溶于稀硫酸后,滴加KSCN溶液,变红,不能说明样品变质 |
| D.室温下,SiO2(s)+3C(s) ═ SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
3 . Na2O2常作漂白剂、杀菌剂、消毒剂。Na2O2保存不当易吸收空气中的CO2而变质。
(1)某课外活动小组欲探究某Na2O2样品是否已经变质:取少量样品加水溶解,加入_______ 溶液,充分振荡后有白色沉淀,则可证明该Na2O2样品已变质。
(2)该小组欲进一步测定其变质的程度,他们称取ag样品,设计用下列组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:

①将仪器连接好以后,必须进行的第一步操作是_______ ;
②B中NaHCO3可能发生的反应的离子方程式 为_______ ;
③C中Na2O2发生反应的化学方程式 为_______ (如有多个,只写一个);
④D中NaOH溶液的作用是_______ ;
⑤实验结束,样品完全反应,量筒F内水的体积为VL,已知此条件下该气体的密度为ρg/L,则该样品中过氧化钠的质量分数为_______ (用含V、ρ的的字母表示)
(1)某课外活动小组欲探究某Na2O2样品是否已经变质:取少量样品加水溶解,加入
(2)该小组欲进一步测定其变质的程度,他们称取ag样品,设计用下列组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:

①将仪器连接好以后,必须进行的第一步操作是
②B中NaHCO3可能发生的反应的
③C中Na2O2发生反应的
④D中NaOH溶液的作用是
⑤实验结束,样品完全反应,量筒F内水的体积为VL,已知此条件下该气体的密度为ρg/L,则该样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
4 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 实验 | 现象 | 结论 | |
| A. | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液 | 有白色沉淀生成 | Na2SO3晶体已氧化变质 |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D. | 把除去氧化膜的铝箔迅速放到酒精灯火焰上加热 | 铝熔化后滴落 | 铝熔点低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-10-13更新
|
192次组卷
|
4卷引用:陕西省西安中学2021届高三第二次月考化学试题
名校
5 . 氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取
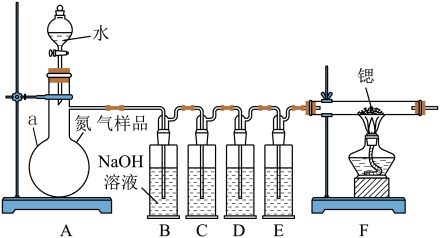
(1)仪器a的名称是__________________ 。
(2)装置C、D、E盛装的试剂分别是_______________ (填代号)。
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____ 。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)
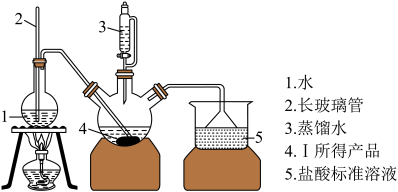
(4)三颈烧瓶中发生反应的化学方程式为_________________________________ 。
(5)装置中长玻璃管的作用原理是_________ 。
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为__________________ 。
(7)产品纯度为_____________ 。(保留三位有效数字)
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是____________ (填字母)。
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取

(1)仪器a的名称是
(2)装置C、D、E盛装的试剂分别是
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)

(4)三颈烧瓶中发生反应的化学方程式为
(5)装置中长玻璃管的作用原理是
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为
(7)产品纯度为
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
您最近一年使用:0次
2020-05-21更新
|
510次组卷
|
3卷引用:重庆市第一中学2020届高三下学期5月月考(全国2)理综化学试题
重庆市第一中学2020届高三下学期5月月考(全国2)理综化学试题湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
解题方法
6 . 铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为_________ (取整数)。
(2)在实验室中,FeCl2可用铁粉和_________ 反应制备,FeCl3可用铁粉和_________ 反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________ ,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________ ;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________ 。(填序号)。
A.若无固体剩余,则溶液中可能含有 、
、 、
、 、
、 四种离子
四种离子
B.若溶液中有 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应 发生
发生
D.当溶液中有 存在时,则一定没有
存在时,则一定没有 析出
析出
(4)高铁酸钾( )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为_________ , 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为________ 。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物
 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为(2)在实验室中,FeCl2可用铁粉和
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:
A.若无固体剩余,则溶液中可能含有
 、
、 、
、 、
、 四种离子
四种离子B.若溶液中有
 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余C.若有固体剩余,则溶液中一定有反应
 发生
发生D.当溶液中有
 存在时,则一定没有
存在时,则一定没有 析出
析出(4)高铁酸钾(
 )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 下列有关实验、现象、及结论等叙述正确的有
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
| A.1条 | B.2条 | C.3条 | D.4条 |
您最近一年使用:0次
2019-12-10更新
|
994次组卷
|
3卷引用:辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题
名校
8 . 下列化学物质在实际生产、生活和科技等方面的叙述正确的是( )
| A.二氧化硅是太阳能电池的主要材料 |
| B.SO2、漂白粉、活性炭、Na2O2都能使品红溶液褪色,其原理相同 |
| C.在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D.某雨水样品放置一段时间后,酸性增强,是因为溶解了CO2 |
您最近一年使用:0次
名校
9 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向包有Na2O2粉末的脱脂棉滴2滴水 | 脱脂棉燃烧 | Na2O2与水反应放热 |
| B | Fe(NO3)2样品中加入稀硫酸,再滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2样品已经变质 |
| C | 向FeCl3溶液中加入Mg(OH)2悬浊液,振荡 | 沉淀由白色变为红褐色 | Fe(OH)3的溶度积小于Mg(OH)2 |
| D | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-01更新
|
1119次组卷
|
3卷引用:重庆八中2018届高三高考适应性月考(五)理科综合化学试题
10 . 无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
Ⅰ. 实验室可用下列装置制备无水AlCl3。

(1)组装好仪器后,首先应_____________ ,具体操作为_____________________
(2)装置 B中盛放饱和NaCl溶液,该装置的主要作用是__________________ 。装置C中盛放的试剂是________________ 。装置F中试剂的作用是__________ 。若用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_______
(3)将所制得的无水AlCl3配制溶液时需加入盐酸的目的是_________
Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

(1)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为___________________
(2)700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为_______
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数________ (结果用m、n表示,不必化简)。
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
Ⅰ. 实验室可用下列装置制备无水AlCl3。

(1)组装好仪器后,首先应
(2)装置 B中盛放饱和NaCl溶液,该装置的主要作用是
(3)将所制得的无水AlCl3配制溶液时需加入盐酸的目的是
Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

(1)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为
(2)700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数
您最近一年使用:0次



