名校
解题方法
1 . 铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置是___________ ,已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因___________ 。
(2)一个 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为___________ 。 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是___________ ,解释原因___________ 。
(4) 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: 、
、 ,
, 。其转化关系如图所示:
。其转化关系如图所示: 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是___________ 。
② 与
与 的结合能力
的结合能力___________ (填“>”、“=”或“<”) 与
与 的结合能力。
的结合能力。
③若 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的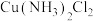 ;
; 的空间构型是
的空间构型是___________ ;。
在有机溶剂的溶解度:(m)___________ (n)(填“>”、“=”或“<”)。
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题: 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为___________ 。
②构成叶绿素的非金属元素中,N和O第一电离能较大的为___________ ,请从原子结构角度解释原因___________ 。
(1)铜元素在元素周期表中的位置是
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(2)一个
 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为
 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是(4)
 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: 、
、 ,
, 。其转化关系如图所示:
。其转化关系如图所示: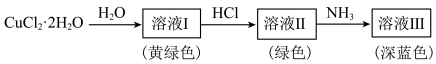
 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是②
 与
与 的结合能力
的结合能力 与
与 的结合能力。
的结合能力。③若
 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的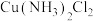 ;
;
 的空间构型是
的空间构型是在有机溶剂的溶解度:(m)
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题:

 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为②构成叶绿素的非金属元素中,N和O第一电离能较大的为
您最近一年使用:0次
解题方法
2 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:________ (填字母)。
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为________ ,电负性Si________ H(填“>”或“<”)。
②该反应的化学方程式为________ 。
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
(4)写出基态Ga原子价层电子排布式________ 。
(5)As的第一电离能比Se大的主要原因是:________________ 。
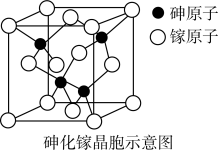
(6)下图为砷化镓晶胞示意图,写出其化学式________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
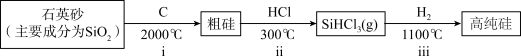
a.ⅰ中,C做还原剂 b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸 d.元素的电负性C>Si
(2)ⅱ中,1molSi与3molHCl反应转移4mole-。
①SiHCl3中,H的化合价为
②该反应的化学方程式为
(3)ⅲ中,利用物质沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。
科学家在元素周期表中Si的附近寻找到元素Ga和As(它们在周期表中的位置如图),并制成它们的化合物薄膜,其晶体结构类似单晶硅。
| Si | |||
| Ga | As | Se |
(4)写出基态Ga原子价层电子排布式
(5)As的第一电离能比Se大的主要原因是:
(6)下图为砷化镓晶胞示意图,写出其化学式
您最近一年使用:0次
名校
解题方法
3 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成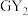 、
、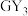 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)X的气态氢化物的电子式为_____ ,工业合成X的气态氢化物的化学方程式为______ 。
(3)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,G的最高价氧化物对应的水化物的浓溶液与金属铜反应的化学方程式为_______ 。
(5)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、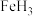
D.比较这两种元素单质与酸或碱反应的难易程度
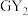 、
、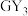 两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
两种分子;X的气态氢化物与其最高价氧化物对应的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:(1)Y在元素周期表中的位置为
(2)X的气态氢化物的电子式为
(3)Y、Z、G三种元素原子半径由大到小的顺序是
(4)Z、M最高价氧化物对应的水化物相互反应的离子方程式为
(5)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、
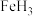
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
名校
4 . 如图为元素周期表的一部分,列出了前四周期11种主族元素在周期表中的位置。

请回答下列问题:
(1)元素E的原子结构示意图为___________ ,I在元素周期表中的位置为___________ ,C与I形成的化合物的电子式为___________ 。
(2)G与J形成原子数之比为 的化合物P,P是日常生活中常见的物质,P分子的结构式为
的化合物P,P是日常生活中常见的物质,P分子的结构式为___________ ,空间构型为___________ ,P的沸点与元素K的氢化物的沸点大小关系为___________ (用化学式表示),原因是___________ 。
(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为___________ 。
(4)J、F、G、K可以形成原子个数之比为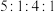 的化合物M,M的化学式为
的化合物M,M的化学式为___________ ;M中含有的化学键类型为___________ ,J、F、G、K还可以形成原子个数之比为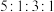 的化合物N,M与N反应的离子方程式为
的化合物N,M与N反应的离子方程式为___________ 。
(5)下列各图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________ 。

请回答下列问题:
(1)元素E的原子结构示意图为
(2)G与J形成原子数之比为
 的化合物P,P是日常生活中常见的物质,P分子的结构式为
的化合物P,P是日常生活中常见的物质,P分子的结构式为(3)元素D的氧化物与氢氧化钠溶液反应的离子方程式为
(4)J、F、G、K可以形成原子个数之比为
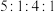 的化合物M,M的化学式为
的化合物M,M的化学式为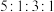 的化合物N,M与N反应的离子方程式为
的化合物N,M与N反应的离子方程式为(5)下列各图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是
 |  |  |
| A.原子半径 | B.原子最外层电子数 | C.原子序数 |
您最近一年使用:0次
名校
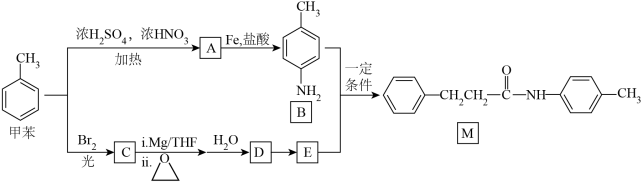
5 . 一种以甲苯为原料合成有机物M的设计路线如下: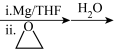
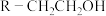
回答下列问题:
(1)B所含官能团的名称是_____ 。
(2)A的名称是_____ ,A→B中加入Fe的目的是_____ 。
(3)甲苯→A的反应类型是_____ ,甲苯→C的化学方程式为_____ 。
(4)在制药行业中常用“成盐修饰”改善物质的理化性质,若用饱和 溶液对E进行“成盐修饰”,可将E转化为
溶液对E进行“成盐修饰”,可将E转化为_____ (用结构简式表示)。
(5)用结构简式表示满足下列条件的D的同分异构体_____ 。
①苯环上只有两个取代基;
②核磁共振氢谱中有6组吸收峰;
③分子中只含有1个手性碳原子
(6)根据已有知识并结合上述合成路线图的相关信息,写出以乙烯为原料,选用必要的无机试剂,合成高分子物质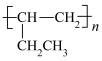 的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)_____ 。

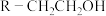
回答下列问题:
(1)B所含官能团的名称是
(2)A的名称是
(3)甲苯→A的反应类型是
(4)在制药行业中常用“成盐修饰”改善物质的理化性质,若用饱和
 溶液对E进行“成盐修饰”,可将E转化为
溶液对E进行“成盐修饰”,可将E转化为(5)用结构简式表示满足下列条件的D的同分异构体
①苯环上只有两个取代基;
②核磁共振氢谱中有6组吸收峰;
③分子中只含有1个手性碳原子
(6)根据已有知识并结合上述合成路线图的相关信息,写出以乙烯为原料,选用必要的无机试剂,合成高分子物质
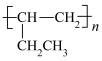 的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
您最近一年使用:0次
2023-08-15更新
|
283次组卷
|
4卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)(已下线)题型04 有机合成设计-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)广西桂林市2022-2023学年高二下学期期末考试化学试题广东省珠海市斗门区第一中学2023-2024学年高三上学期阶段性考试化学试题



