1 . 四氧化三铁(Fe3O4)俗称磁性氧化铁,在工业上应用广泛,可作催化剂、磁记录材料等。Fe3O4的一种制备方法如下:
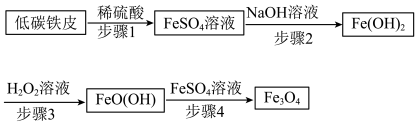
(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作___________ 。
A.正极 B.负极
②反应过程中,溶液的pH___________ 。
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在 ,可选用的试剂是___________。
,可选用的试剂是___________。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(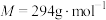 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。
①称量时,需用到的仪器有___________ 。
②根据计算,选用的容量瓶规格应为___________ 。
A.100mL B.250mL C.500mL D.1000mL
(4)步骤2用下图所示装置制备 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
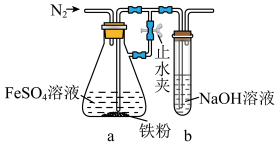
止水夹关闭前后,通入N2的作用分别为___________ 、___________ 。
(5)步骤3的反应原理为: 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为___________ 。
(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。
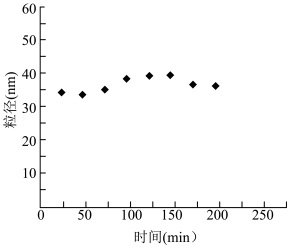
①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因___________ 。
②写出一种可使Fe3O4较快形成沉淀的方法___________ 。

(1)低碳铁皮与稀硫酸反应时,会形成许多微小原电池。
①形成原电池时,Fe作
A.正极 B.负极
②反应过程中,溶液的pH
A.变大 B.变小 C.不变
(2)检验步骤1得到的FeSO4溶液中是否存在
 ,可选用的试剂是___________。
,可选用的试剂是___________。| A.KSCN溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
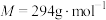 )固体,配制成
)固体,配制成 K2Cr2O7标准溶液。
K2Cr2O7标准溶液。①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)步骤2用下图所示装置制备
 。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
。制备时,先打开止水夹,通入N2一段时间;再关闭止水夹,继续通入N2一段时间。
止水夹关闭前后,通入N2的作用分别为
(5)步骤3的反应原理为:
 。反应中每消耗34gH2O2,转移的电子数为
。反应中每消耗34gH2O2,转移的电子数为(6)步骤4在不同时刻得到的Fe3O4粒径大小如下图所示。

①实验过程中,Fe3O4不易形成沉淀,结合上图分析原因
②写出一种可使Fe3O4较快形成沉淀的方法
您最近一年使用:0次
2 . 实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去 、
、 、
、 等可溶性杂质。
等可溶性杂质。
(1)写出NaCl溶于水时的电离方程式___________ 。
(2)为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、 、CaCO3和
、CaCO3和___________ 。
 、
、 、
、 等可溶性杂质。
等可溶性杂质。(1)写出NaCl溶于水时的电离方程式
(2)为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、
 、CaCO3和
、CaCO3和
您最近一年使用:0次
3 . NH3是制备氮肥的原料之一。
(1)写出NH3的电子式。___________
(2)下列关于NH3的说法错误的是___________。
(1)写出NH3的电子式。
(2)下列关于NH3的说法错误的是___________。
| A.极易溶于水 | B.可用作制冷剂 | C.属于电解质 | D.属于共价化合物 |
您最近一年使用:0次
4 . 下列关于氢分子说法错误的是_________ 。
A.氢分子中含有共价键
B.氢分子的空间填充模型可表示为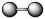
C.氢气液化时,氢分子间平均距离变小
A.氢分子中含有共价键
B.氢分子的空间填充模型可表示为

C.氢气液化时,氢分子间平均距离变小
您最近一年使用:0次
5 .  表示
表示
 表示
表示| A.氯原子的结构示意图 | B.氯离子的结构示意图 |
| C.氯原子的电子式 | D.氯离子的电子式 |
您最近一年使用:0次
6 . NaCl属于
| A.酸 | B.碱 | C.盐 | D.氧化物 |
您最近一年使用:0次
名校
7 . 数字化实验是化学研究的重要手段。实验小组将电导率传感器插入20.00mL 0.1mol·L-1 H2SO4溶液中,向溶液中匀速滴入等浓度的BaCl2溶液,电导率与溶液体积图像如图所示。 (已知溶液导电性越强,电导率值越大),请回答下列问题。
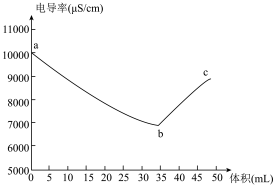
(1)按物质分类,BaCl2属于_______ (选填“强电解质”或“弱电解质”)。
(2)其它条件相同的情况下,溶的导电性由_______ 决定。
(3)用离子方程式解释图中 a→b段曲线变化的原因_______ 。
(4)对 b、c 两处溶液的c(H+)进行比较,b_______ c(选填“>”或“=”或“<”), 说明原因_______ 。
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
(6)向 0.1 mol·L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像正确的是
(7)在无色溶液中能大量共存的一组离子是
(8)下列物质的溶液不能将Al(OH)3溶解的是

(1)按物质分类,BaCl2属于
(2)其它条件相同的情况下,溶的导电性由
(3)用离子方程式解释图中 a→b段曲线变化的原因
(4)对 b、c 两处溶液的c(H+)进行比较,b
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
| A.在 b 上方 | B.与 b 重合 | C.在 b 下方 | D.无法确定 |
A.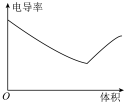 | B.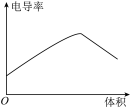 |
C.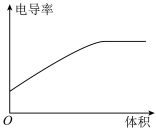 | D.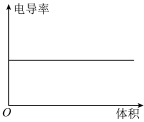 |
A.NO 、Cl-、Na+、Ca2+ 、Cl-、Na+、Ca2+ | B.Ag+、NO 、OH-、Na+ 、OH-、Na+ |
C.Mg2+、MnO 、K+、I- 、K+、I- | D.HCO 、OH-、Ca2+、Na+ 、OH-、Ca2+、Na+ |
| A.NaOH | B.NaCl | C.H2SO4 | D.HCl |
您最近一年使用:0次
名校
8 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
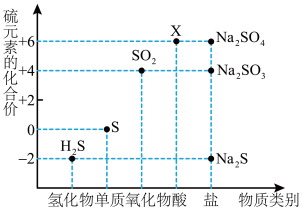
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
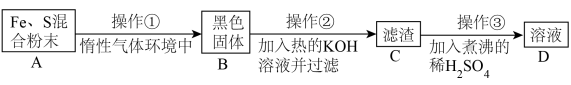
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
名校
9 . 卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
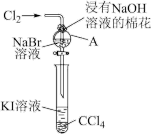
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
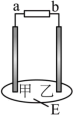
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近一年使用:0次
解题方法
10 . 铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为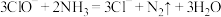 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有_______ 。
(2)规定义:氨氮脱除率
氨氮脱除率受溶液pH 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:
图示为最适宜pH条件,NaClO和 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。

试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:_____ 。
(3)由上述信息判断,反应的最佳pH范围是_______ ,最佳投料比是_______ 。
生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
(4)氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为_______ 。写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:_______ 。
(5)在VLamol·L 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为_______ 。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为
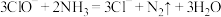 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有(2)规定义:氨氮脱除率

氨氮脱除率受溶液pH
 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:| pH | 反应前氮元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:
(3)由上述信息判断,反应的最佳pH范围是
生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。(4)氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:(5)在VLamol·L
 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为
您最近一年使用:0次



