1 . 某化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4_______ HCl(填“>”或“<”)。
(2)用离子方程式解释II中实验现象产生的原因:_______ 、Fe3++3SCN-=Fe(SCN)3。
(3)IV中发生反应的离子方程式为_______ 。
(4)该补铁药中琥珀酸亚铁变质程度为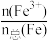 ×100%=
×100%=_______ (保留3位有效数字)。
(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是_______ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释II中实验现象产生的原因:
(3)IV中发生反应的离子方程式为
(4)该补铁药中琥珀酸亚铁变质程度为
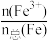 ×100%=
×100%=(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次
2023-08-26更新
|
169次组卷
|
5卷引用:作业(十九) 铁及其化合物之间的转化关系
2 . 部分被氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中含氧元素的物质的量为0.03 mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol
④V=224mL
⑤V=336mL

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②样品中含氧元素的物质的量为0.03 mol
③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol
④V=224mL
⑤V=336mL
| A.①③④ | B.②③④ | C.②③⑤ | D.①③⑤ |
您最近一年使用:0次
2021-09-15更新
|
1533次组卷
|
10卷引用:人教版(2019)高一必修第一册 第三章 铁 金属材料 章末综合检测卷
人教版(2019)高一必修第一册 第三章 铁 金属材料 章末综合检测卷【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题福建2020届高三化学总复习专题训练——无极工艺流程选择填空题江西省南昌市第二中学2019-2020学年高二下学期期末考试化学试题黑龙江省大庆市铁人中学2019-2020学年高二下学期期末考试化学试题河北正定中学2020-2021学年高一上学期第三次月考化学试题湖南省长沙市湖南师大附中2022-2023学年高一下学期第一次月考化学试题 湖南师范大学附属中学2022-2023学年高一下学期第一次月考化学试题湖北省仙桃中学2022-2023学年高一下学期第一次段考化学试题云南省昆明市第八中学2023-2024学年高一上学期12月月考化学试题
3 . 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒(Se)可能成为环境污染物,可通过与浓HNO3或浓H2SO4反应后,经SO2还原来回收Se。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出化学方程式:__ 。
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O(Ⅰ)
2SO2+SeO2+2H2O=Se+2SO +4H+(Ⅱ)
+4H+(Ⅱ)
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是__ 。
(3)可以通过下面的方法测定回收得到的SeO2样品中SeO2的含量:
①SeO2+KI+HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,用双线桥标出电子转移的方向和数目___ 。
(4)按(3)中的方法测定SeO2的含量。实验中,准确称量SeO2样品0.1500g,消耗0.2000mol•L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为___ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出化学方程式:
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O(Ⅰ)
2SO2+SeO2+2H2O=Se+2SO
 +4H+(Ⅱ)
+4H+(Ⅱ)SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)可以通过下面的方法测定回收得到的SeO2样品中SeO2的含量:
①SeO2+KI+HNO3=Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,用双线桥标出电子转移的方向和数目
(4)按(3)中的方法测定SeO2的含量。实验中,准确称量SeO2样品0.1500g,消耗0.2000mol•L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
20-21高一上·江苏南通·开学考试
名校
4 . 研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按下图高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
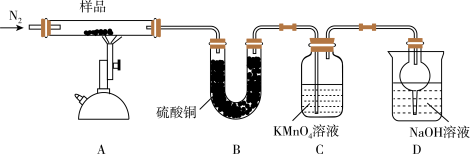
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有_____ (填分子式)。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在_____ (填氧化性或还原性)气体_____ (填分子式)。
(4)实验中要持续通入氮气,否则测出的x会_____ (填“偏大”、“偏小”或“不变”)。
(5)从理论上分析得出硫酸亚铁分解还生成另-物质三氧化硫,写出硫酸亚铁分解的化学方程式____ 。
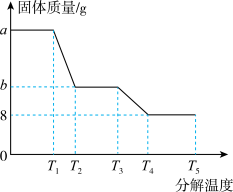
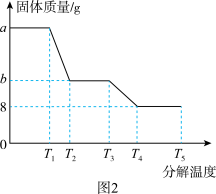
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量一分解温度的关系如图,根据图中有关数据,可计算出FeSO4·xH2O中的x=_____ 。(写出计算过程)

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在
(4)实验中要持续通入氮气,否则测出的x会
(5)从理论上分析得出硫酸亚铁分解还生成另-物质三氧化硫,写出硫酸亚铁分解的化学方程式
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量一分解温度的关系如图,根据图中有关数据,可计算出FeSO4·xH2O中的x=

您最近一年使用:0次
2020-08-31更新
|
370次组卷
|
3卷引用:第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
(已下线)第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江苏省启东中学2020-2021学年高一上学期期初考试化学试题河北省张家口市宣化第一中学2021-2022学年高一上学期期初考试化学试题
19-20高一·全国·单元测试
5 . 研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
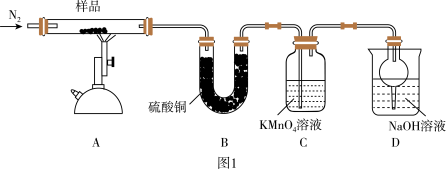
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在气体______ 。
(4)实验中要持续通入氮气,否则测出的x会_____ (填“偏大”、“偏小”或“不变”)。
(5)从理论上分析得出硫酸亚铁分解还生成另一物质三氧化硫,写出硫酸亚铁分解的化学方程式________ 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x=______ 。


(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在气体
(4)实验中要持续通入氮气,否则测出的x会
(5)从理论上分析得出硫酸亚铁分解还生成另一物质三氧化硫,写出硫酸亚铁分解的化学方程式
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x=
您最近一年使用:0次



