名校
1 . 按要求填空
(1)浓硫酸具有如下的性质: A.酸性B.强氧化性C.吸水性D.脱水性,E难挥发性。下列事实主要表现浓硫酸的什么性质(填字母序号)。
①浓硫酸使蔗糖变黑___________ ;
②碳投入热的浓硫酸中溶解___________ ;
③浓硫酸与氧化铜反应___________ ;
④浓硫酸干燥氢气___________ 。
(2)浓硝酸具有如下的性质:A.酸性B.强氧化性C.不稳定性,下列事实主要表现浓硝酸的什么性质(填字母序号)。
①浓硝酸需避光保存___________ ;
②常温下可用铝或者铁遇浓硝酸钝化___________ 。
(3)二氧化硫气体在下列反应中表现的性质填写在横线上(填字母序号)。
A氧化性 B.漂白性 C.还原性 D.酸性氧化物的性质
①SO2+2OH= +H2O
+H2O___________ ;
②SO2+2H2S=3S↓+2H2O___________ ;
③SO2+Ca(OH)2=CaSO3↓+H2O___________ ;
④SO2+Cl2+2H2O=2HCl+H2SO4___________ 。
(4)氮元素是地球大气中含量最多的元素,请完成下列有关问题:
①写出氮元素的原子结构示意图:___________ 。
②通常情况下,氮气性质不活泼,其原因是___________ 。
A氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
③N2的电子式:___________ 。
④氨是一种重要的化工原料,请写出工业合成氨的化学方程式:___________ 。
⑤检验NH3的方法是___________ 。
(1)浓硫酸具有如下的性质: A.酸性B.强氧化性C.吸水性D.脱水性,E难挥发性。下列事实主要表现浓硫酸的什么性质(填字母序号)。
①浓硫酸使蔗糖变黑
②碳投入热的浓硫酸中溶解
③浓硫酸与氧化铜反应
④浓硫酸干燥氢气
(2)浓硝酸具有如下的性质:A.酸性B.强氧化性C.不稳定性,下列事实主要表现浓硝酸的什么性质(填字母序号)。
①浓硝酸需避光保存
②常温下可用铝或者铁遇浓硝酸钝化
(3)二氧化硫气体在下列反应中表现的性质填写在横线上(填字母序号)。
A氧化性 B.漂白性 C.还原性 D.酸性氧化物的性质
①SO2+2OH=
 +H2O
+H2O②SO2+2H2S=3S↓+2H2O
③SO2+Ca(OH)2=CaSO3↓+H2O
④SO2+Cl2+2H2O=2HCl+H2SO4
(4)氮元素是地球大气中含量最多的元素,请完成下列有关问题:
①写出氮元素的原子结构示意图:
②通常情况下,氮气性质不活泼,其原因是
A氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
③N2的电子式:
④氨是一种重要的化工原料,请写出工业合成氨的化学方程式:
⑤检验NH3的方法是
您最近一年使用:0次
2 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____ ,氧化性最弱的简单阳离子是____ 。
(2)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是_____ ;制铝时,电解Al2O3而不电解AlCl3的原因是_____ 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)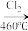 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)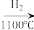 Si(纯)
Si(纯)
写出SiCl4的电子式:_____ ;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____ 。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为
(2)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)
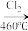 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)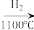 Si(纯)
Si(纯)写出SiCl4的电子式:
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
3 . 次氯酸(HClO)的浓溶液呈黄色,是极强氧化剂,常用作消毒剂及除甲醛(HCHO)的试剂。某学习小组设计下列装置制备HClO并验证其氧化性(夹持仪器及降温装置已省略)。
已知: 为棕黄色气体,极易溶于水并迅速反应生成HClO。
为棕黄色气体,极易溶于水并迅速反应生成HClO。

回答下列问题:
(1)HClO的结构式为___________ ,仪器a的名称为___________ 。
(2)制备HClO时要打开活塞K1、K3,关闭K2,待装置A中反应结束时再通入一段时间N2。
①仪器C中制备 时,发生反应的化学方程式为
时,发生反应的化学方程式为
___________ (填化学式),仪器B、D中的试剂分别为___________ (填字母)。
a.浓 、
、 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
②反应结束后再通入一段时间N2的目的是___________ 。
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。
①将E中HClO溶液转移到F中的具体操作为___________ (答出对开关的操作)。
②反应结束时,F的溶液中含有的离子主要有 、
、 、
、 、
、 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
已知:
 为棕黄色气体,极易溶于水并迅速反应生成HClO。
为棕黄色气体,极易溶于水并迅速反应生成HClO。
回答下列问题:
(1)HClO的结构式为
(2)制备HClO时要打开活塞K1、K3,关闭K2,待装置A中反应结束时再通入一段时间N2。
①仪器C中制备
 时,发生反应的化学方程式为
时,发生反应的化学方程式为
a.浓
 、
、 b.饱和食盐水、
b.饱和食盐水、 c.饱和食盐水、浓
c.饱和食盐水、浓
②反应结束后再通入一段时间N2的目的是
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。
①将E中HClO溶液转移到F中的具体操作为
②反应结束时,F的溶液中含有的离子主要有
 、
、 、
、 、
、 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
4 . 硫的多种化合物在工业中有重要的应用。
(1)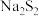 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出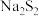 的电子式
的电子式___________ 。
(2)连二亚硫酸钠 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
① 中S元素的化合价为
中S元素的化合价为___________ 。
②将甲酸(HCOOH)和NaOH溶液混合,再通入 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为___________ 。
(3)铬会造成环境污染,某酸性废水中含有 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。
①写出 参加反应的离子方程式
参加反应的离子方程式___________ 。
②处理后的废水中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)
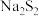 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出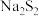 的电子式
的电子式(2)连二亚硫酸钠
 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。①
 中S元素的化合价为
中S元素的化合价为②将甲酸(HCOOH)和NaOH溶液混合,再通入
 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为(3)铬会造成环境污染,某酸性废水中含有
 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。①写出
 参加反应的离子方程式
参加反应的离子方程式②处理后的废水中
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
5 . 关于M元素的有关图示,下列说法不正确的是
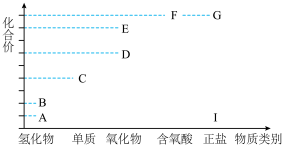
A.依据题给价一类二维图综合分析可知 元素为氮元素. 元素为氮元素. |
B.物质B可用作火箭燃料,其电子式为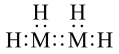 |
C.D或 均可在一定条件下与 均可在一定条件下与 反应得到C 反应得到C |
| D.物质F的浓溶液具有强氧化性,可以用铁制或铝制容器盛放 |
您最近一年使用:0次
名校
解题方法
6 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题:
(1)上述元素中,金属性最强的是___________ (填元素名称),最高价氧化物对应水化物酸性最强的是___________ (写出酸的化学式)。
(2)由元素③形成的单质的电子式为___________ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程___________ 。
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为___________ 。
(4)可以比较⑤、⑥两元素金属性强弱的实验是___________。
| 族周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由元素③形成的单质的电子式为
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)可以比较⑤、⑥两元素金属性强弱的实验是___________。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
您最近一年使用:0次
7 . 1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

(1)元素c代表的元素是(写元素符号)___________ 。
(2)请写出元素e在元素周期表中所在的位置___________ 。
(3)请画出元素f的简单离子结构示意图___________ 。请写出单质f与d的最高价氧化物对应的水化物反应的离子方程式___________ 。
(4)元素h的最高价氧化物对应的水化物呈___________ (酸性、中性或碱性);请写出元素i的单质与水反应的化学方程式___________ 。

(1)元素c代表的元素是(写元素符号)
(2)请写出元素e在元素周期表中所在的位置
(3)请画出元素f的简单离子结构示意图
(4)元素h的最高价氧化物对应的水化物呈
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分,①~⑫分别代表12种元素,请回答:

(1)写出由元素⑫构成的单质的电子式___________ 。
(2)⑧在元素周期表中的位置是___________
(3)③的气态氢化物发生催化氧化的化学方程式是___________ ;②④⑨分别与①形成的简单气态化合物的稳定性由强到弱的顺序___________ (写化学式)
(4)以下验证⑤⑥⑦⑪四种元素金属性强弱的方法和结论均正确的是___________(填字母序号)。
(5)等质量的⑥、⑦、Zn三种金属分别与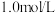
 的盐酸充分反应,产生氢气的质量大小关系的猜测有a.
的盐酸充分反应,产生氢气的质量大小关系的猜测有a. ;b.
;b. ;c.
;c. :d.
:d. :e.
:e. 。其中肯定错误的猜测是
。其中肯定错误的猜测是___________ 。(填字母序号)
(6)酸性条件下,⑧号元素主要以 形式存在。工业上处理含
形式存在。工业上处理含 的废水,可以采取向废水中加入亚硫酸钠溶液,写出发生的离子反应方程式
的废水,可以采取向废水中加入亚硫酸钠溶液,写出发生的离子反应方程式___________ 。

(1)写出由元素⑫构成的单质的电子式
(2)⑧在元素周期表中的位置是
(3)③的气态氢化物发生催化氧化的化学方程式是
(4)以下验证⑤⑥⑦⑪四种元素金属性强弱的方法和结论均正确的是___________(填字母序号)。
A.比较四种元素形成的最高价氧化物对应的水化物碱性强弱: |
B.比较四种元素形成氢化物的难易程度以及氢化物的热稳定性: |
C.比较四种元素形成的单质分别与非氧化性酸反应置换氢气的剧烈程度: |
D.比较四种元素形成的单质在反应中作为还原剂时失去电子的数目: |
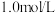
 的盐酸充分反应,产生氢气的质量大小关系的猜测有a.
的盐酸充分反应,产生氢气的质量大小关系的猜测有a. ;b.
;b. ;c.
;c. :d.
:d. :e.
:e. 。其中肯定错误的猜测是
。其中肯定错误的猜测是(6)酸性条件下,⑧号元素主要以
 形式存在。工业上处理含
形式存在。工业上处理含 的废水,可以采取向废水中加入亚硫酸钠溶液,写出发生的离子反应方程式
的废水,可以采取向废水中加入亚硫酸钠溶液,写出发生的离子反应方程式
您最近一年使用:0次
名校
9 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题:
(1)上述元素中,金属性最强的是_________ (填元素名称),最高价氧化物对应水化物酸性最强的是_________ (写出酸的化学式)。
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:_________ 。(用离子符号表示)
(3)由元素③形成的单质的电子式为_________ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程__________________ 。
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为_________ 。
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系__________________ 。
(6)可以比较⑤、⑥两元素金属性强弱的实验是_________。
族周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:
(3)由元素③形成的单质的电子式为
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系
(6)可以比较⑤、⑥两元素金属性强弱的实验是_________。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分,根据A~G在元素周期表中的位置,回答下列问题:
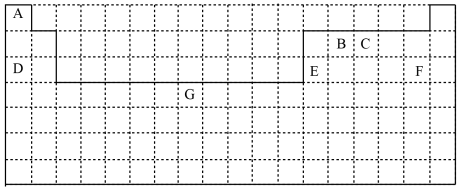
(1)F在元素周期表中的位置是_______ 。
(2)E的氧化物属于_______ 氧化物(填“酸性”、“碱性”或“两性”);单质B在氧气中完全燃烧,其产物的空间结构为_______ ;用电子式表示化合物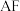 的形成过程:
的形成过程:_______ 。
(3)化合物DA可做野外生氢剂,写出该化合物与水反应的化学方程式为_______ 。
(4)C、D、E、F四种元素离子半径由大到小的顺序是_______ (填离子符号)。
(5)单质G在一定条件下能与水蒸气反应,其化学反应方程式为_______ ;该反应的氧化产物俗称_______ 。

(1)F在元素周期表中的位置是
(2)E的氧化物属于
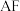 的形成过程:
的形成过程:(3)化合物DA可做野外生氢剂,写出该化合物与水反应的化学方程式为
(4)C、D、E、F四种元素离子半径由大到小的顺序是
(5)单质G在一定条件下能与水蒸气反应,其化学反应方程式为
您最近一年使用:0次
2023-02-19更新
|
152次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高一上学期1月期末化学试题



